HOC247 mời quý thầy, cô và các em tham khảo nội dung bài học Liên kết Hydrogen và tương tác Van der Waals được HOC247 biên soạn chi tiết của sách Hóa học 10 Kết nối tri thức. Qua việc tìm hiểu để các em có thể so sánh được tính chất vật li giữa các phân tử dựa vào liên kết hydrogen và tương tác van der Waals, hi vọng bài học này sẽ giúp các em phát huy trí tưởng tượng của mình. Chúc các em học vui!
Tóm tắt lý thuyết
1.1. Mở đầu
- Các tính chất vật lí của các chất có liên kết cộng hoá trị được quyết định bởi lực tương tác giữa các phân tử, hình dạng của phân tử và mức độ phân cực của liên kết cộng hoá trị trong phân tử.
+ Keo dán là một ví dụ về việc sử dụng lực tương tác giữa các phân tử để gân các vật với nhau.
+ Bong bóng xà phòng thể hiện tương tác giữa các phân tử nước và các phần tử xà phòng tạo thành màng mỏng, giữ được không khí bên trong để bay lên.
- Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết cộng hoá trị hay liên kết kim loại. Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác Van der Waals (Van đơ Van).
1.2. Liên kết Hydrogen
a. Bản chất của liên kết hydrogen
- Các phân tử HF, H2O, NH3 có chứa nguyên tử H (độ âm điện là 2,2) và các nguyên tử phi kim có độ âm điện lớn (F = 3,98; O = 3,44; N = 3,04).
- Sự chênh lệch độ âm điện lớn làm cho các liên kết phân cực, cặp electron dùng chung trong liên kết cộng hoá trị bị hút lệch về phía các nguyên tử F, O, N, tạo thành khu vực có điện tích âm (\({\delta ^ - }\))
- Nguyên tử hydrogen trong các phần tử HF, H2O, NH3 rất linh động, có điện tích dương (\({\delta ^ + }\)) đủ lớn để hút cặp electron hoá trị chưa liên kết trên nguyên từ F, O hoặc N (của phân từ khác) có độ âm điện lớn tạo thành liên kết hydrogen.
- Liên kết hydrogen thường được biểu diễn bằng dấu ba chấm (...) giữa các nguyên từ (Hình 13.1).
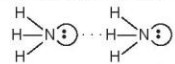 hay vẽ đơn giản
hay vẽ đơn giản 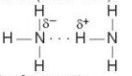
Hình 13.1. Liên kết hydrogen giữa hai phân tử ammonia
- Điều kiện cần và đủ để tạo thành liên kết hydrogen:
+ Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như H, O, N...
+ Nguyên từ F, O, N...liên kết với hydrogen phải có ít nhất một cặp electron hoá trị chưa liên kết
- Một số kiều tạo thành liên kết hydrogen:

a) Liên kết giữa các phân tử cùng bại b) Liên kết giữa các phân tử khác loại
Hình 13.2. Hai kiểu tạo thành liên kết hydrogen
b. Vai trò và ảnh hưởng của liên kết hydrogen tới tính chất vật lý của nước
- Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
Bảng 13.1. Nhiệt độ nóng chảy và nhiệt độ sôi một số chất
| H2O | H2S | CH4 | |
|
Nhiệt độ nóng chảy (°C)
|
0 | -85,6 | -182,5 |
| Nhiệt độ sôi (°C) | 100 | -60,75 | -161,58 |
Số liệu Bàng 13.1 cho thấy: do ảnh hưởng của liên kết hydrogen nên nhiệt độ nóng chảy và nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4.
|
- Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hoá trị chưa tham gia liên kết. - Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước. |
|---|
1.3. Tương tác Van der Waals
a. Khái niệm tương tác van der Waals
- Cùng là phần tử không phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí còn bromine là chất lỏng. Như vậy, ở trạng thái lỏng, giữa các phần tử bromine tồn tại một tương tác yêu. Tương tác yêu đó gọi là tương tác van der Waals.
- Các khí hiếm như neon, argon,... tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên nhiệt độ thấp, khi hiểm có thể hoá lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên từ khi hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực - lưỡng cực giữa các nguyên tử hay phân tử.
b. Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất
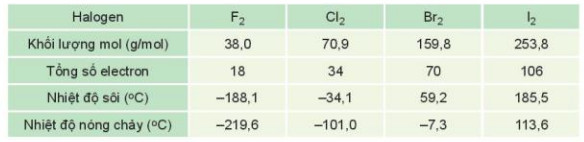
Ví dụ 1: Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất (Bảng 13.2)
Bảng 13.2. Nhiệt độ nóng chảy và nhiệt độ sôi tăng khi tương tác van der Waals tăng
Ví dụ 2: Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạnh không phân nhánh pentane có nhiệt độ sôi (36°C) cao hơn so với đồng phân mạch nhanh neopentane (9,5°C) do diện tích tiếp xúc giữa các phần từ pentarie lớn hơn nhiều so với neopentane.
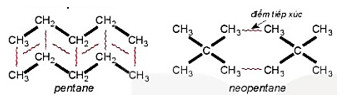
Hình 13.5. Tương tác van der Waals giữa các phần tử perkane và neopertane
Hình 13.5 cho thấy để phá vỡ lực liên phân tử giữa các phân tử pentane cân nhiều năng lượng hơn so với neopentane, nên nhiệt độ sôi cao hơn.
|
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực được hình thành giữa các phân tử hay nguyên tử. - Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. |
|---|
Bài tập minh họa
Bài 1: Ở áp suất khí quyển, nhiệt độ sôi của H2O là 1000C, CH4 là -161,580C, H2S là -60,280C. Vì sao các chất trên có nhiệt độ sôi khác nhau.
Hướng dẫn giải
- Liên kết hydrogen được hình thành giữa nguyên tử hydrogen với các nguyên tử có độ âm điện lớn và các nguyên tử này phải có 1 ít nhất một cặp electron hóa trị chưa tham gia liên kết.
- Do O và S đều còn 2 cặp electron hóa trị chưa tham gia liên kết, C không còn cặp electron hóa trị tự do nên H2O và H2S có thể tạo liên kết hydrogen trong phân tử, còn CH4 thì không.
→ Nhiệt độ sôi của H2O và H2S lớn hơn CH4.
- Do độ âm điện của O lớn hơn S nên liên kết hydrogen trong phân tử H2O mạnh hơn trong phân tử H2S.
→ Nhiệt độ sôi của H2O lớn hơn H2S.
Bài 2: Hãy giải thích sự khác nhau về nhiệt độ sôi của butane và isobutane.
Hướng dẫn giải
- Diện tích tiếp xúc giữa các phân tử càng lớn thì nhiệt độ sôi càng lớn.
- Đồng phân mạch không phân nhánh butane có nhiệt độ sôi cao hơn so với đồng phân mạch phân nhánh isobutan do diện tích tiếp xúc giữa các phân tử butane lớn hơn nhiều so với isobutane.
Luyện tập Bài 13 Hóa 10 KNTT
Sau bài học này, học sinh có thể:
- Trình bày được khái niệm liên kết hydrogen. Vận dụng để giải thích sự xuất hiện liên kết hydrogen (với nguyên tố có độ âm điện lớn: N, O, F).
- Nêu được vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước.
- Nêu được khái niệm về tương tác Van der Waals và ảnh hưởng của tương tác này tới nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
3.1. Trắc nghiệm Bài 13 Hóa 10 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Kết nối tri thức Bài 13 cực hay có đáp án và lời giải chi tiết.
-
- A. Trong hợp chất ion, các nguyên tố kim loại thuộc nhóm IA, IIA, IIIA có điện hoá trị 1+, 2+, 3+.
- B. Trong hợp chất SO3 , S có điện hóa trị là 6+.
- C. Các nguyên tố phi kim thuộc nhóm VIA, VIIA có thể có điện hoá trị 2-, 1-.
- D. Trong hợp chất ion, hoá trị của một nguyên tố bằng điện tích của ion và được gọi là điện hoá trị của nguyên tố đó.
-
- A. 1 liên kết đơn
- B. 3 liên kết đơn
- C. 1 liên kết đôi
- D. 1 liên kết ba
-
- A. 3 liên kết π.
- B. 1 liên kết π, 2 liên kết δ.
- C. 1 liên kết δ, 2 liên kết π.
- D. 3 liên kết δ.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 13 Hóa 10 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Kết nối tri thức Bài 13 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 66 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 66 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 3 trang 67 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.1 trang 34 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.2 trang 34 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.3 trang 34 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.4 trang 34 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.5 trang 34 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.6 trang 34 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.7 trang 34 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.8 trang 34 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.9 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.10 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.11 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.12 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.13 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.14 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.15 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.16 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.17 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 13.18 trang 35 SBT Hóa học 10 Kết nối tri thức - KNTT
Hỏi đáp Bài 13 Hóa học 10 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





