HỌC247 xin giới thiệu đến các em Phương pháp giải toán phản ứng cộng Hidro vào nguyên tử cacbon chứa liên kết Pi của Hidrocacbon không no. Hi vọng tài liệu ôn tập này sẽ giúp các em ghi nhớ và tư duy gắn kết các kiến thức Hóa học lớp 11, chuẩn bị thật tốt cho các kì thi sắp tới.
I. CƠ SỞ LÝ THUYẾT CỦA PHƯƠNG PHÁP
Trong phân tử của các hiđrocacbon không no có chứa liên kết đôi C = C (trong đó có 1 liên kết và một liên kết \(\pi \)), hoặc liên kết ba C \(\equiv \) C (1 xichma và 2 pi ). Liên kết \(\pi \) là liên kết kém bền vững, nên khi tham gia phản ứng, chúng dễ bị đứt ra để tạo thành sản phẩm chứa các liên kết \(\sigma \) bền vững hơn. Trong giới hạn của đề tài tôi chỉ đề cập đến phản ứng cộng hiđro vào liên kết \(\pi \) của hiđrocacbon không no, mạch hở.
Khi có mặt chất xúc tác như Ni, Pt, Pd, ở nhiệt độ thích hợp, hiđrocacbon không no cộng hiđro vào liên kết pi.
Phương trình hoá học tổng quát:
CnH2n+2-2k + kH2 → CnH2n+2 [1] (k là số liên kết trong phân tử)
Tuỳ vào hiệu suất của phản ứng mà hỗn hợp Y có hiđrocacbon không no dư hoặc hiđro dư hoặc cả hai còn dư.
Dựa vào phản ứng tổng quát [1] ta thấy:
- Trong phản ứng cộng H2, số mol khí sau phản ứng luôn giảm (nX > nY) và số mol khí giảm chính bằng số mol khí H2 phản ứng:
nH2 phản ứng = nX - nY (2)
Mặt khác, theo định luật bảo toàn khối lượng thì khối lượng hỗn hợp X bằng khối lượng hỗn hợp Y (mX = mY).
Ta có: \({\overline M _Y} = \frac{{{m_Y}}}{{{n_Y}}}\)
\({\overline M _X} = \frac{{{m_X}}}{{{n_X}}}\)
Viết gọn lại :
\({d_{X/Y}} = \frac{{{{\overline M }_X}}}{{{{\overline M }_Y}}} = \frac{{{n_Y}}}{{{n_X}}}{\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} \) [3]
- Hai hỗn hợp X và Y chứa cùng số mol C và H nên :
+ Khi đốt cháy hỗn hợp X hay hỗn hợp Y đều cho ta các kết quả sau :
nO2 (đốt cháy X) = nO2 (đốt cháy Y)
nCO2 (đốt cháy X) = nCO2 (đốt cháy Y)
nH2O (đốt cháy X) = nH2O ( đốt cháy Y)
Do đó, khi làm toán, nếu gặp hỗn hợp sau khi đi qua Ni/to đem đốt (thu được hỗn hợp Y) thay vì tính toán trên hỗn hợp Y (thường phức tạp hơn trên hỗn hợp X) ta có thể dùng phản ứng đốt cháy hỗn hợp X để tính số mol các chất như: nO2 pư, nCO2 và nH2O
+ Số mol hiđrocacbon trong X bằng số mol hiđrocacbon trong Y:
|
nhiđrocacbon(X) = nhiđrocacbon(Y) |
1) Xét trường hợp hiđrocacbon trong X là anken
Phương trình hoá học của phản ứng: CnH2n + H2 →CnH2n+2
Đặt nCnH2n = a, nH2 = b
- Nếu phản ứng cộng H2 hoàn toàn thì:
+ TH1: Hết anken, dư H2
\(\left. \begin{array}{l}
{n_{{H_2}pu}} = n{C_n}{H_{2n}} = n{C_n}{H_{2n + 2}} = a\,mol\\
{n_{{H_2}du}} = b - a
\end{array} \right\} \to {n_Y} = n{C_n}{H_{2n + 2}} + {n_{{H_2}}} = b\)
Vậy: nH2 (X) = nY [6]
+ TH2: Hết H2, dư anken
\(\left. \begin{array}{l}
{n_{{H_2}}} = n{C_n}{H_{2n}} = n{C_n}{H_{2n + 2}} = b\,mol\\
n{C_n}{H_{2n + 2}} = a - b
\end{array} \right\} \to {n_Y} = n{C_n}{H_{2n + 2}} + n{C_n}{H_{2n + 2}}du = a\)
Vậy: n anken (X) = n (Y) [7]
...
II. BÀI TẬP ÁP DỤNG
Bài 1: Trong một bình kín dung tích không đổi ở điều kiện chuẩn chưa etilen và H2 có bột Ni xúc tác. Đun nóng bình một thời gian sau đó đưa bình về nhiệt độ ban đầu ( 0oC). Cho biết tỉ khối hơi của hỗn hợp đầu và hỗn hợp sau phản ứng so với H2 lần lượt là 7,5 và 9. Phần trăm thể tích của khí C2H6 trong hỗn hợp khí sau phản ứng là:
A. 40% B. 20% C. 60% D. 50%
Bài giải:
Mtb = 7,5.2 = 15;
My = 9.2 = 18
Các yếu tố trong bài toán không phụ thuộc vào số mol cụ thể của mỗi chất vì số mol này sẽ bị triệt tiêu trong quá trình giải. Vì vậy ta tự chọn lượng chất. Để bài toán trở nên đơn giản khi tính toán, ta chọn số mol hỗn hợp X là 1 mol (nX = 1 mol) mX = mY = 15 (g)
Dựa vào [3] và [6] ta có: \(\frac{{15}}{{18}} = \frac{{{n_Y}}}{1} \Rightarrow {n_Y} = {n_{{H_2}(X)}} = \frac{{15}}{{18}} = \frac{5}{6}{\kern 1pt} {\kern 1pt} (mol)\)
\({\user2{n}_{{\user2{C}_\user2{2}}{\user2{H}_\user2{6}}}} = 1 - \frac{5}{6} = \frac{1}{6}\) (mol)
%VC2H6 = (1/6 : 5/6) .100% = 20%. Chọn đáp án B.
Bài 2: Hỗn hợp khí X chứa H2 và hai anken kế tiếp nhau trong dãy đồng đẳng. Tỉ khối của X đối với H2 là 8,3. Đun nóng nhẹ X có mặt xúc tác Ni thì nó biến thành hỗn hợp Y không làm mất màu nước brom và có tỉ khối đối với H2 là 83/6. Công thức phân tử của hai anken và phần trăm thể tích của H2 trong X là:
A. C2H4 và C3H6; 60% B. C3H6 và C4H8; 40%
C. C2H4 và C3H6; 40% D. C3H6 và C4H8; 60%
Bài giải:
Mx = 8,3.2 = 16,6;
My = \(\frac{{83}}{6}.2 = \frac{{83}}{3}\)
Vì hỗn hợp Y không làm mất màu nước Br2 nên trong Y không có anken
Tự chọn lượng chất, chọn số mol hỗn hợp X là 1 mol (nX = 1 mol)
mX = 16,6g
Dựa vào [3] và [6] ta có: \(\frac{{16,6}}{{\frac{{83}}{3}}} = \frac{{{n_Y}}}{1} \Rightarrow {n_Y} = {n_{{H_2}(X)}} = \frac{{16,6.3}}{{83}} = 0,6({\kern 1pt} mol)\)
n2 anken = 1- 0,6=0,4 mol
Dựa vào khối lượng hỗn hợp X:
Ta có: m2 anken = mX - = 16,6 – 0,6.2 = 15,4 (g).
Suy ra \({\overline \user2{M} _{\user2{2anken}}} = \frac{{15,4}}{{0,4}} = 38,5\) = 14n = 38,5 → 2 < n = 2,75 < 3
CTPT: C2H4 và C3H6;
\(\% {V_{{H_{2{\kern 1pt} {\kern 1pt} (X)}}}} = \frac{{0,6}}{1} \times 100\% = 60\% \)
Chọn A.
Bài 3: (Đề TSCĐ năm 2009) Hỗn hợp khí X gồm H2 và C2H4 có tỉ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 5. Hiệu suất của phản ứng hiđro hoá là:
A. 25% B. 20% C. 50% D. 40%
Bài giải:
Mx = 3,75.4 = 15;
My = 5.4 = 20
Tự chọn lượng chất, coi nX = 1 mol
Dựa vào [3] ta có: \(\frac{{15}}{{20}} = \frac{{{n_Y}}}{1} \Rightarrow {n_Y} = \frac{{15}}{{20}} = 0,75{\kern 1pt} {\kern 1pt} mol\)
Áp dụng sơ đồ đường chéo :
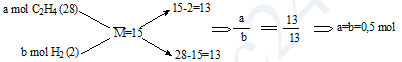
\(H = \frac{{0,25}}{{0,5}} \times 100\% = 50\% \)
Chọn C.
Bài 4: (Đề TSĐH KB năm 2009) Hỗn hợp khí X gồm H2 và một anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất. Tỉ khối của X so với H2 bằng 9,1. Đun nóng X có xúc tác Ni, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y không làm mất màu nước brom; tỉ khối của Y so với H2 bằng 13. Công thức cấu tạo của anken là:
A. CH3-CH=CH-CH3. B. CH2=CH-CH2-CH3.
C. CH2=C(CH3)2. D. CH2=CH2.
Bài giải:
Mx = 9,1.2 = 18,2;
My = 13.2 = 26
Vì hỗn hợp Y không làm mất màu nước Br2 nên trong Y không có anken.
Tự chọn lượng chất, chọn số mol hỗn hợp X là 1 mol → mX = 18,2gam.
Dựa vào [3] và [6] ta có:
\(\frac{{18,2}}{{26}} = \frac{{{n_Y}}}{1} \Rightarrow {n_Y} = {n_{{H_2}(X)}} = \frac{{18,2}}{{26}} = 0,7{\kern 1pt} {\kern 1pt} mol\)
→ nanken = 1- 0,7=0,3 mol
Dựa vào khối lượng hỗn hợp X: \(14n \times 0,3 + 2 \times 0,7 = 18,2 \Rightarrow n = 4\)
CTPT: C4H8.
Vì khi cộng HBr cho sản phẩm hữu cơ duy nhất nên chọn A.
...
III. LUYỆN TẬP
Bài 1: Hỗn hợp X gồm một olefin M và H2 có khối lượng phân tử trung bình 10,67 đi qua Ni nung nóng thu được hỗn hợp Y có tỉ khối so với H2 bằng 8. Biết M phản ứng hết. CTPT của M là:
A. C3H6
B. C5H10
C. C4H8
D. C2H4
Bài 2: Một hỗn hợp gồm một ankin và H2 có thể tích bằng 8,96 lít ( đktc) và mX = 4,6 g. Cho hỗn hợp X qua Ni nóng, phản ứng hoàn toàn cho ra hỗn hợp khí Y có tỉ khối so với hỗn hợp X bằng 2. Số mol H2 phản ứng, khối lượng và CTPT của ankin là:
A. 0,2 mol H2; 4g C3H4
B. 0,16 mol H2; 3,6g C2H2
C. 0,2 mol H2; 4g C2H2
D. 0,3 mol H2; 2g C3H4
Bài 3: Cho hỗn hợp X gồm etilen và H2 có tỉ khối so với H2 bằng 4,25. Dẫn X qua bột Ni nung nóng (hiệu suất phản ứng hiđro hoá anken bằng 75%), thu được hỗn hợp Y. Tính tỉ khối của Y so với H2. Các thể tích khí đo ở đktc.
Bài 4: Cho 22,4 lít hỗn hợp khí X (đktc) gồm CH4, C2H4, C2H2 và H2 có tỉ khối đối với H2 là 7,3 đi chậm qua ống sứ đựng bột Niken nung nóng ta thu được hỗn hợp khí Y có tỉ khối đối với H2 là 73/6. Cho hỗn hợp khí Y di chậm qua bình nước Brom dư ta thấy có 10,08 lít (đktc) khí Z thoát ra có tỉ khối đối với H2 bằng 12 thì khối lượng bình đựng Brom đã tăng thêm
A. 3,8 gam
B. 2,0 gam
C. 7,2 gam
D. 1,9 gam
Bài 5: Một hỗn hợp khí X gồm Ankin A và H2 có thể tích 15,68 lít. Cho X qua Ni nung nóng, phản ứng hoàn toàn cho ra hỗn hợp khí Y có thể tích 6,72 lít (trong Y có H2 dư). Thể tích của A trong X và thể tích của H2 dư lần lượt là (các thể tích đo ở điều kiện tiêu chuẩn)
A. 2,24 lít và 4,48 lít
B. 3,36 lít và 3,36 lít
C. 1,12 lít và 5,60 lít
D. 4,48 lít và 2,24 lít.
Bài 6: Đun nóng hỗn hợp khí X gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom (dư) thì còn lại 0,448 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch brom tăng là:
A. 1,04 gam.
B. 1,20 gam.
C. 1,64 gam.
D. 1,32 gam.
Bài 7: Hỗn hợp khí X chứa H2 và một anken. Tỉ khối của X đối với H2 là 9. Đun nóng nhẹ X có mặt xúc tác Ni thì nó biến thành hỗn hợp Y không làm mất màu nước brom và có tỉ khối đối với H2 là 15. Công thức phân tử của anken là
A. C2H4
B. C3H6
C. C4H8
D. C4H6
Bài 8: Hỗn hợp khí A chứa H2 và một anken. Tỉ khối của A đối với H2 là 6,0. Đun nóng nhẹ A có mặt xúc tác Ni thì nó biến thành hỗn hợp B không làm mất màu nước brom và có tỉ khối đối với H2 là 8,0. Xác định công thức phân tử và phần trăm thể tích từng chất trong hỗn hợp A và hỗn hợp B.
Bài 9: Hỗn hợp khí A chứa H2 và hai anken kế tiếp nhau trong dãy đồng đẳng. Tỉ khối của A đối với H2 là 8,26. Đun nóng nhẹ A có mặt xúc tác Ni thì nó biến thành hỗn hợp B không làm mất màu nước brom và có tỉ khối đối với H2 là 11,80. Xác định công thức phân tử và phần trăm thể tích của từng chất trong hỗn hợp A và hỗn hợp B.
Bài 10: Cho 8,96 lít hỗn hợp khí X gồm C3H8, C2H2, C3H6, CH4 và H2 đi qua bột Niken xúc tác nung nóng để phản ứng xảy ra hoàn toàn, sau phản ứng ta thu được 6,72 lít hỗn hợp khí Y không chứa H2. Thể tích hỗn hợp các hidrocacbon có trong X là:
A. 5,6 lít
B. 4,48 lít
C. 6,72 lít
D. 8,96 lít
...
Trên đây chỉ trích một phần câu hỏi trong tài liệu Phương pháp giải toán phản ứng cộng Hidro vào nguyên tử cacbon chứa liên kết Pi của Hidrocacbon không no. Để xem toàn bộ nội dung các em vui lòng đăng nhập vào trang HỌC247.net và tải về máy tính.
Hy vọng bộ đề này giúp các em học sinh lớp 11 ôn tập tốt và đạt thành tích cao nhất trong kì thi sắp tới. Chúc các em học tốt!
Tư liệu nổi bật tuần
-
Đề cương ôn tập giữa HK1 môn Vật lý 12 năm 2023 - 2024
09/10/20231152 -
Đề cương ôn tập giữa HK1 môn Ngữ văn 12 năm 2023-2024
09/10/2023655 - Xem thêm
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)


