Câu hỏi trắc nghiệm (40 câu):
-
Câu 1: Mã câu hỏi: 416905
Trong các sản phẩm sau, sản phẩm nào không phải là sản phẩm của hóa học?
- A. Phân bón hóa học.
- B. Thuốc.
- C. Dầu gội đầu.
- D. Thực phẩm biến đổi gen.
-
Câu 2: Mã câu hỏi: 416910
Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
- A. Sự phân chia của tế bào.
- B. Sự hô hấp của sinh vật.
- C. Sự chuyển hóa thức ăn trong hệ tiêu hóa.
- D. Sự quang hợp của cây xanh.
-
Câu 3: Mã câu hỏi: 416915
Nguyên tử chứa các hạt mang điện là
- A. proton và hạt nhân.
- B. proton và neutron.
- C. electron và neutron.
- D. proton và electron.
-
Câu 4: Mã câu hỏi: 416917
Lớp thứ M có số phân lớp là
- A. 1
- B. 2
- C. 3
- D. 4
-
Câu 5: Mã câu hỏi: 416923
Số electron tối đa chứa trong lớp L là
- A. 2.
- B. 8.
- C. 18.
- D. 32.
-
Câu 6: Mã câu hỏi: 416927
Cấu hình electron của nguyên tử có Z = 15 là
- A. 1s23s22p63s23p2.
- B. 1s23s22p63s23p4.
- C. 1s23s22p63s23p3.
- D. 1s23s22p53s23p4.
-
Câu 7: Mã câu hỏi: 416928
Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Số electron trong A là
- A. 12.
- B. 24.
- C. 13.
- D. 6.
-
Câu 8: Mã câu hỏi: 416930
Số proton và số neutron có trong một nguyên tử aluminium (\({}_{13}^{27}Al\)) lần lượt là
- A. 13 và 14.
- B. 13 và 15.
- C. 12 và 14.
- D. 13 và 13.
-
Câu 9: Mã câu hỏi: 416931
Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
(1) Các đồng vị có tính chất hóa học giống nhau.
(2) Các đồng vị có tính chất vật lí khác nhau.
(3) Các đồng vị có cùng số electron ở vỏ nguyên tử.
(4) Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
- A. 1
- B. 2
- C. 3
- D. 4
-
Câu 10: Mã câu hỏi: 416935
Lớp M có số orbital tối đa bằng
- A. 3
- B. 4
- C. 9
- D. 18
-
Câu 11: Mã câu hỏi: 416938
Sự phân bố electron theo ô orbital nào sau đây là đúng?
-
A.

-
B.
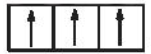
-
C.
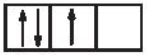
-
D.
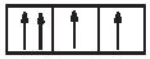
-
A.
-
Câu 12: Mã câu hỏi: 416957
Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z = 19). Dãy gồm các nguyên tố kim loại là
- A. X, Y, E.
- B. X, Y, E, T.
- C. E, T.
- D. Y, T.
-
Câu 13: Mã câu hỏi: 416964
Cho các nguyên tố sau: X (Z = 11); Y (Z = 19); T (Z = 20); Q (Z = 17). Nguyên tố phi kim là
- A. X (Z = 11).
- B. Q (Z = 17).
- C. Y (Z = 19).
- D. T (Z = 20).
-
Câu 14: Mã câu hỏi: 416974
Ion X2+ có 10 electron. Trong bảng tuần hoàn, X thuộc ô số
- A. 10.
- B. 12.
- C. 8.
- D. 9.
-
Câu 15: Mã câu hỏi: 416984
Nguyên tử nguyên tố X có tổng các electron trên phân lớp p là 7. Vậy X thuộc loại nguyên tố nào sau đây?
- A. s.
- B. d.
- C. f.
- D. p.
-
Câu 16: Mã câu hỏi: 416986
Nguyên tố X có số hiệu nguyên tử bằng 15. Hydroxide cao nhất của nó có tính chất gì?
- A. Acid.
- B. Base.
- C. Trung tính.
- D. Lưỡng tính.
-
Câu 17: Mã câu hỏi: 416988
Bán kính nguyên tử của các nguyên tố: Li (Z = 3), O (Z = 8), F (Z = 9), Na (Z = 11) được xếp theo chiều tăng dần từ trái sang phải là
- A. F, O, Li, Na.
- B. Li, Na, O, F
- C. F, Na, O, Li.
- D. F, Li, O, Na.
-
Câu 18: Mã câu hỏi: 416991
Nguyên nhân của sự biến đổi tuần hoàn tính chất các nguyên tố là sự biến đổi tuần hoàn
- A. của điện tích hạt nhân.
- B. của số hiệu nguyên tử.
- C. cấu hình electron lớp ngoài cùng của nguyên tử.
- D. cấu trúc lớp vỏ electron của nguyên tử.
-
Câu 19: Mã câu hỏi: 416993
Trong bảng hệ thống tuần hoàn, độ âm điện của các nguyên tố biến đổi như thế nào?
- A. Tăng dần trong một chu kì
- B. Giảm dần trong một phân nhóm chính.
- C. Biến thiên giống tính phi kim.
- D. Tăng dần theo tính kim loại.
-
Câu 20: Mã câu hỏi: 416996
Nguyên tố X thuộc chu kì 3, nhóm VIA. Cấu hình electron của nguyên tử X là
- A. 1s22s22p4.
- B. 1s22s22p63s23p4.
- C. 1s22s22p63s23p1.
- D. 1s22s22p63s23p3.
-
Câu 21: Mã câu hỏi: 416998
Chu kì 3 của bảng hệ thống tuần hoàn có
- A. 2 nguyên tố.
- B. 8 nguyên tố.
- C. 10 nguyên tố.
- D. 18 nguyên tố.
-
Câu 22: Mã câu hỏi: 417001
Hạt nhân nguyên tử Y có 15 proton. Vị trí của Y trong bảng tuần hoàn là
- A. số thứ tự 15, chu kì 3, nhóm VIIA.
- B. số thứ tự 15, chu kì 2, nhóm VA.
- C. số thứ tự 15, chu kì 3, nhóm VA.
- D. số thứ tự 15, chu kì 4, nhóm VA.
-
Câu 23: Mã câu hỏi: 417002
Trong một nhóm, từ trên xuống dưới thì số lớp electron
- A. tăng dần.
- B. giảm dần.
- C. không thay đổi.
- D. biến đổi không theo quy luật.
-
Câu 24: Mã câu hỏi: 417004
Cấu hình electron nào sau đây ứng với nguyên tố có độ âm điện lớn nhất?
- A. 1s22s22p5.
- B. 1s22s22p6.
- C. 1s22s22p63s1.
- D. 1s22s22p63s23p2.
-
Câu 25: Mã câu hỏi: 417007
Công thức oxide cao nhất của nguyên tố R (Z = 17) là
- A. R2O.
- B. R2O3.
- C. R2O5.
- D. R2O7.
-
Câu 26: Mã câu hỏi: 417011
Nguyên tố K có số hiệu nguyên tử là 19. Phát biểu nào sau đây về K là không đúng?
- A. Số electron ở vỏ nguyên tử của nguyên tố K là 19.
- B. Vỏ của nguyên tử K có 4 lớp electron và lớp ngoài cùng có 1 electron
- C. Hạt nhân của nguyên tố K có 19 proton.
- D. Nguyên tố K là một phi kim.
-
Câu 27: Mã câu hỏi: 417015
Ion Y- có cấu hình electron 1s22s22p63s23p6. Vị trí của Y trong bảng tuần hoàn (chu kì, nhóm) là
- A. Chu kì 3, nhóm VIIA.
- B. Chu kì 3, nhóm VIA.
- C. Chu kì 4, nhóm IA.
- D. Chu kì 4, nhóm IIA.
-
Câu 28: Mã câu hỏi: 417018
Trong các phản ứng hoá học, các nguyên tử kim loại có khuynh hướng
- A. nhận thêm electron.
- B. nhận hay nhường electron phụ thuộc vào từng phản ứng cụ thể.
- C. nhường electron.
- D. nhận hay nhường electron phụ thuộc vào từng kim loại cụ thể.
-
Câu 29: Mã câu hỏi: 417020
Công thức được viết dựa trên công thức electron, trong đó mỗi cặp electron chung được thay bằng một gạch nối “–” gọi là
- A. công thức cấu tạo thu gọn.
- B. công thức Lewis.
- C. công thức phân tử.
- D. công thức cấu tạo.
-
Câu 30: Mã câu hỏi: 417024
Trong các hợp chất sau đây, hợp chất nào có liên kết ion?
- A. HCl.
- B. H2O.
- C. NH3.
- D. NaCl.
-
Câu 31: Mã câu hỏi: 417027
Nitrogen (N) là nguyên tố thuộc nhóm VA, chu kì 2 của bảng tuần hoàn. Cho các phát biểu sau:
(a) Nguyên tử N có 2 lớp electron và có 5 electron lớp ngoài cùng.
(b) Công thức oxide cao nhất của N có dạng NO2 và là acidic oxide.
(c) Nguyên tố N có tính phi kim mạnh hơn nguyên tố O (Z = 8).
(d) Hydroxide ứng với oxide cao nhất của N có dạng HNO3 và có tính acid.
Số phát biểu đúng là
- A. 1
- B. 2
- C. 3
- D. 4
-
Câu 32: Mã câu hỏi: 417029
Liên kết hóa học là
- A. sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
- B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
- C. sự kết hợp của các phân tử hình thành các chất bền vững.
- D. sự kết hợp của chất tạo thành vật thể bền vững.
-
Câu 33: Mã câu hỏi: 417032
Cho các phát biểu sau về hợp chất ion:
(1) Không dẫn điện khi nóng chảy.
(2) Dễ hòa tan trong các dung môi hữu cơ.
(3) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(4) Khó tan trong nước.
Số phát biểu đúng là
- A. 1
- B. 2
- C. 3
- D. 4
-
Câu 34: Mã câu hỏi: 417035
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là
- A. liên kết ion.
- B. liên kết cộng hoá trị.
- C. liên kết kim loại.
- D. liên kết hydrogen.
-
Câu 35: Mã câu hỏi: 417036
Phát biểu nào sau đây là sai khi nói về liên kết trong phân tử HCl?
- A. Phân tử HCl là phân tử phân cực.
- B. Các electron liên kết bị hút lệch về một phía nguyên tử chlorine.
- C. Cặp electron dùng chung nằm chính giữa hai nguyên tử hydrogen và chlorine.
- D. Nguyên tử hydrogen và chlorine liên kết với nhau bằng một liên kết đơn.
-
Câu 36: Mã câu hỏi: 417039
Chất nào sau đây có liên kết cộng hóa trị không phân cực?
- A. O2.
- B. KCl.
- C. H2O.
- D. HF.
-
Câu 37: Mã câu hỏi: 417040
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
- A. 3
- B. 6
- C. 5
- D. 4
-
Câu 38: Mã câu hỏi: 417041
Tương tác van der Waals
- A. làm giảm nhiệt độ nóng chảy, nhưng làm tăng nhiệt độ sôi các chất.
- B. làm giảm nhiệt độ nóng chảy và nhiệt độ sôi các chất.
- C. làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất.
- D. không làm thay đổi nhiệt độ nóng chảy và nhiệt độ sôi các chất.
-
Câu 39: Mã câu hỏi: 417043
Chọn đáp án đúng nhất. Vì sao HF có nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI?
- A. HF có phân tử khối lớn nhất.
- B. HF có liên kết hydrogen.
- C. HF có tương tác van der Waals lớn nhất.
- D. HF là hợp chất phân cực nhất.
-
Câu 40: Mã câu hỏi: 417047
Khi hình thành liên kết cộng hóa trị trong phân tử H – F, số electron dùng chung giữa hai nguyên tử H và F là
- A. 1
- B. 2
- C. 3
- D. 4





