Giải bài 16.15 trang 44 SBT Hóa học 10 Kết nối tri thức
Quặng pyrite có thành phần chính là FeS2 được dùng làm nguyên liệu để sản xuất sulfuric acid. Xét phản ứng đốt cháy:
\(Fe{S_2} + {O_2}\mathop \to \limits^{{t^o}} F{e_2}{O_3} + S{O_2}\)
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
b) Tính thể tích không khí (chứa 21% thể tích oxygen ở điều kiện chuẩn) cần dùng để đốt cháy hoàn toàn 2,4 tấn FeS2 trong quặng pyrite
Hướng dẫn giải chi tiết bài 16.15
Phương pháp giải:
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=>Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải chi tiết:
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
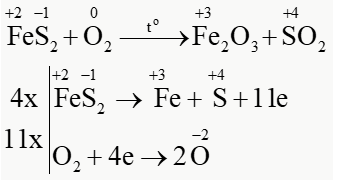
PTHH: \(4Fe{S_2} + 11{O_2}\mathop \to \limits^{{t^o}} 2F{e_2}{O_3} + 8S{O_2}\)
b)
\({n_{{O_2}}} = \frac{{11}}{4}.{n_{Fe{S_2}}} = \frac{{11}}{4}{.2.10^4} = 5,{5.10^4}\)
\({n_{Fe{S_2}}} = \frac{{2,{{4.10}^6}}}{{120}} = {2.10^4}(mol)\)
Theo PTHH: (mol)
\({V_{{O_2}}} = 24,79.5,{5.10^4} = 1363450L\)
\({V_{kk}} = \frac{{100}}{{21}}.{V_{{O_2}}} = 6492619L\)
-- Mod Hóa Học 10 HỌC247
Bài tập SGK khác
Chưa có câu hỏi nào. Em hãy trở thành người đầu tiên đặt câu hỏi.





