Hướng dẫn Giải bài tập Hóa học 10 Kết nối tri thức Bài 10 Bài 10: Quy tắc Octet môn Hóa học lớp 10 KNTT giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải câu hỏi 1 trang 49 SGK Hóa học 10 Kết nối tri thức - KNTT
Khi nguyên tử fluorine nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
-
Giải câu hỏi 2 trang 49 SGK Hóa học 10 Kết nối tri thức - KNTT
Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng nào?
-
Giải câu hỏi 3 trang 50 SGK Hóa học 10 Kết nối tri thức - KNTT
Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử F2, CCl4 và NF3.
-
Giải câu hỏi 4 trang 50 SGK Hóa học 10 Kết nối tri thức - KNTT
Phosphine là hợp chất hoá học giữa phosphorus với hydrogen, có công thức hoá học là PH3. Đây là chất khí không màu, có mùi tỏi, rất độc, không bền, tự cháy trong không khí ở nhiệt độ thường và tạo thành khối phát sáng bay lơ lửng. Phosphine sinh ra khi phân huỷ xác động, thực vật và thường xuất hiện trong thời tiết mưa phùn (hiện tượng “ma trơi"). Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hoá học trong phosphine.
- VIDEOYOMEDIA
-
Giải bài 10.1 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Liên kết hoá học là
A. sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
-
Giải bài 10.2 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Theo quy tắc octet, khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
A. kim loại kiềm gần kề.
B. kim loại kiềm thổ gần kề.
C. nguyên tử halogen gần kề.
D. nguyên tử khí hiếm gần kể.
-
Giải bài 10.3 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Khi hình thành liên kết hoá học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
A. (Z = 12).
B. (Z = 9).
C. (Z=11).
D. (Z=10).
-
Giải bài 10.4 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Công thức cấu tạo nào sau đây không đủ electron theo quy tắc octet?
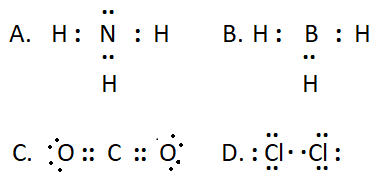
-
Giải bài 10.5 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
A. 2.
B. 3.
C. 4.
D. 5.
-
Giải bài 10.6 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Phân tử nào sau đây có các nguyên tử đều đã đạt cấu hình electron bão hòa theo quy tắc octet?
A. BeH2.
B. AlCl3.
C. PCl5.
D. SiF4
-
Giải bài 10.7 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
A. H2O.
B. NO2.
C. CO2.
D. Cl2.
-
Giải bài 10.8 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Trong tự nhiên, các khí hiếm tồn tại dưới dạng nguyên tử tự do. Các nguyên tử của khí hiếm không liên kết với nhau tạo thành phân tử và rất khó liên kết với các nguyên tử của các nguyên tố khác. Ngược lại nguyên tử các nguyên tố khác lại liên kết với nhau tạo thành phân tử hay tinh thể. Giải thích.
-
Giải bài 10.9 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Cấu hình electron lớp ngoài cùng của nguyên tử potassium (kali) là 4s1, cấu hình electron lớp ngoài cùng của nguyên tử bromine là 4s24p5. Làm thể nào các nguyên tử potassium và bromine có được cấu hình electron của nguyên tử khí hiếm theo quy tắc octet.
-
Giải bài 10.10 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Khi hình thành liên kết H + Cl → HCl và khi phá vỡ liên kết HCl → H + Cl thì hệ thu năng lượng hay toả năng lượng. Năng lượng phân tử HCl lớn hơn hay nhỏ hơn năng lượng hệ hai nguyên tử H và Cl riêng rẽ? Trong hai hệ đó thì hệ nào bền hơn?
-
Giải bài 10.11 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Trong phân tử Na2S, cấu hình electron của các nguyên tử có tuân theo quy tắc octet không?
-
Giải bài 10.12 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử O2, CO2, CaCl2, KBr.
-
Giải bài 10.13 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Đá vôi (thành phần chính là CaCO3) được dùng để sản xuất vôi, trong lĩnh vực xây dựng... Barium nitrate Ba(NO3)2 có trong thành phần của kính quang học, gốm, men,… Phèn đơn aluminium sulfate (thành phần chính là Al2(SO4)3) được sử dụng rộng rãi trong xử lí nước thải, trong công nghệ sản xuất giấy, công nghệ nhuộm vải và công nghệ lọc nước và nuôi trồng thuỷ sản,... Dựa vào tắc octet, đề xuất công thức cấu tạo của các chất trên.Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử O2, CO2, CaCl2, KBr.
-
Giải bài 10.14 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Hợp chất X tạo bởi hai nguyên tố A, D có khối lượng phân tử là 76. X là dung môi không phân cực, thưởng được sử dụng làm nguyên liệu trong tổng hợp chất hữu cơ chứa lưu huỳnh và được sử dụng rộng rãi trong sản xuất vải viscoza mềm. A có công thức hydride dạng AH4 và D có công thức oxide ứng với hoá trị cao nhất dạng DO3.
a) Hãy thiết lập công thức phân tử của X. Biết rằng A có số oxi hoá cao nhất trong X.
b) Để xuất công thức cấu tạo của X và cho biết các nguyên tử thành phần của X khi liên kết có đủ electron theo quy tắc octet không.





