Thông qua nội dung bài học Bài 22: Hydrogen Halide. Muối Halide môn Hóa học lớp 10 chương trình Kết nối tri thức được HOC247 biên soạn và tổng hợp sẽ giúp các em học sinh:
- Nhận xét, giải thích được xu hướng biến đổi nhiệt độ sôi của các hydrogen halide từ HCl tới HI.
- Giải thích được sự bất thường về nhiệt độ sôi của HF so với các HX khác.
- Trình bày được xu hướng biến đổi tính acid của dãy hydrohalic acid.
Cùng tham khảo nội dung đầy đủ, chi tiết bên dưới đây nhé!
Tóm tắt lý thuyết
1.1. Hydrogen Halide
a. Cấu tạo phân tử
- Phân tử hydrogen halide (HX) gồm một liên kết cộng hoá trị. Các phân tử HX là phân tử phân cực.
.jpg) hoặc H-X
hoặc H-X
- Mô hình liên kết:

Bảng 22.1. Một số đặc điểm của hydrogen halide
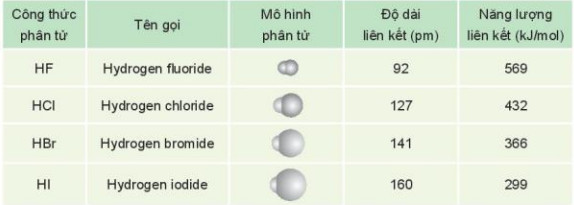
b. Tính chất vật lí
- Ở điều kiện thường, hydrogen halide tồn tại ở thể khi, tan tốt trong nước, tạo thành dung dịch hydrohalic acid tương ứng.
Bảng 22.2. Nhiệt độ sôi (ts) của các hydrogen halide
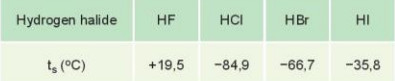
- HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen: H-F ... H-F ... H-F
- Từ HC đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng.
|
Hydrogen halide: HF có nhiệt độ sôi cao bất thường do giữa các phân tử có liên kết hydrogen từ HCl đến HI nhiệt độ sôi tăng dần do tương tác van der Waals tăng dần. |
|---|
1.2. Hydrohalic acid
a. Tính chất hóa học
- Tính acid
+ Trong dãy hydrohalic acid, tính acid tăng từ hydrofluoric acid (yếu) đến hydroiodic acid (rất mạnh).
- Tính khử
+ Ngoài tỉnh acid, hydrohalic acid còn có tính khử, ví dụ: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
b. Ứng dụng
- Hydrogen fluoride
+ Hydrogen fluoride được sử dụng trong quá trình sản xuất teflon theo sơ đồ:
.jpg)
+ Teflon có hệ số ma sát nhỏ, bền nhiệt, được dùng làm chất chống dính ở nồi, chảo, Hydrofluoric acid còn có khả năng đặc biệt là ăn mòn thuỷ tinh vô cơ (có thành phần gần đúng là Na2O.CaO.6SiO2) do xảy ra phản ứng: SIO2 + 4HF → SiF4 + 2H2O
+ Trong công nghiệp, hỗn hợp gồm KF và HF (có tỉ lệ mol tương ứng 1:3) được dùng để điện phân nóng chảy sản xuất fluorine.
- Hydrogen chloride
+ Trong sản xuất tôn, thép, hydrochloric acid được sử dụng phổ biến để loại bỏ gỉ sét trên sắt thép trước khi chuyển sang các công đoạn sản xuất tiếp theo. Ở kĩ thuật này, dung dịch HC thường dùng với nồng độ khoảng 18%.
+ Trong công nghiệp, hydrochloric acid được dùng để sản xuất các hợp chất vô cơ và hữu cơ như aluminium chloride dùng làm chất phụ gia chống nhoè cho giấy, PAC (poli aluminium chloride) dùng để xử lý nước, nickel chloride dùng trong mạ điện, zing chloride dùng trong sản xuất pin, vinyl chloride dùng sản xuất PVC,...
+ Trong sản xuất nước uống đóng chai, hydrochloric acid tinh khiết được sử dụng để tái sinh các nhựa trao đổi ion nhằm thay thế các ion Na+ và Ca2+ (đã bị hấp phụ trên nhựa trong quá trình khử khoáng nước nguyên liệu) băng ion H+.
|
Hydrohalic acid: tính acid tăng dần từ HF (acid yếu) đến HI (acid rất mạnh). |
|---|
1.3. Muối Halide
a. Tính tan
- Hầu hết các muối halide đều dễ tan trong nước, trừ một số muối không tan như silver chloride, silver bromide, silver iodide và một số muối ít tan như lead chroride, lead bromide.
b. Tính chất hoá học
- Phản ứng trao đổi
- Tính khử của ion halide
+ Sodium bromide khử được sulfuric acid đặc thành sulfur dioxide, còn Sodium iodide có thể khử được sulfuric acid đặc thành hydrogen sulfide.
2NaBr + 2H2SO4 → Na2SO4 + Br2 + SO2 + 2H2O
8Nal + 5H2SO4 → 4Na2SO4 + 4I2 + H2S + 4H2O
+ Trong điều kiện như trên, NaC chỉ xảy ra phản ứng trao đổi, tạo thành hydrogen chloride.
+ Tính khử của các ion halide tăng dần theo thứ tự Cl- < Br- < I-.
c. Muối ăn
- Vai trò của muối ăn
+ Trong cơ thể sống, muối ăn có vai trò quan trọng trong việc cân bằng điện giải, truyền dẫn xung điện thần kinh, trao đổi chất, Trong đời sống, muối ăn được dùng để bảo quản và chế biến thực phẩm (ướp, muối),... Trong y học, muối ăn được dùng sản xuất nước muối sinh lí, nước nhỏ mắt, dịch tiêm truyền tĩnh mạch,...
+ Trong công nghiệp, muối ăn là nguyên liệu để sản xuất xút, chlorine, nước Javel,...
- Tinh chế muối ăn
+ Muối ăn thường được sản xuất từ nước biển bằng phương pháp kết tinh nhờ quá trình làm bay hơi nước biển dưới sức nóng của Mặt Trời.
+ Muối ăn thô thu được trên ruộng muối có lẫn tạp chất như muối của magnesium, calcium. Để đạt độ tinh khiết làm thức ăn cho con người, muối ăn thô cần được kết tinh lại. Trong y học, muối ăn được sử dụng có độ tinh khiết rất cao, do đó cần kết tinh lại nhiều lần.
| lon halide, muối halide: Tính khử tăng dần từ fluoride đến iodide. |
|---|
Bài tập minh họa
Bài 1: Hydrochloric acid được sử dụng rộng rãi trong sản xuất, điển hình là dùng để đánh sạch bề mặt kim loại trước khi gia công, sơn, hàn, mạ điện,… Trong công đoạn này, thép được đưa qua các bể chứa dung dịch HCl (được gọi là bể Picking) để tẩy bỏ lớp rỉ sét, sau đó rửa sạch bằng nước trước khi qua các công đoạn tiếp theo. Vậy các ứng dụng trên dựa vào tính chất quan trọng nào của hydrochloric acid?
Hướng dẫn giải
- Khi thép được đưa qua các bể chứa dung dịch HCl để tẩy bỏ lớp rỉ sét
→ Thể hiện tính chất tác dụng với kim loại của hydrochloric acid, cụ thể là tác dụng với kim loại sắt
Fe + 2HCl → FeCl2 + H2
Bài 2: Tính khối lượng HCl bị oxi hóa bởi MnO2, biết rằng khí Cl2 sinh ra trong phản ứng đó có thể đẩy được 12,7g I2 từ dung dịch NaI.
Hướng dẫn giải
- Phương trình hóa học của phản ứng: Cl2 + 2NaI → 2NaCl + I2
- Theo bài ra, ta có: nI2 = 12,7/254 = 0,05 (mol).
- Theo PTPƯ: nCl2 = nI2 = 0,05 (mol).
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
nHCl = 4.nCl2 = 4.0,05 = 0,2 mol.
⇒ Khối lượng HCl cần dùng là: mHCl = 0,2.36,5 = 7,3 (g).
Bài 3: Cho 300ml một dung dịch có hòa tan 5,85g NaCl tác dụng với 200ml dung dịch có hòa tan 34g AgNO3, người ta thu được một kết tủa và nước lọc.
a) Tính khối lượng chất kết tủa thu được.
b) Tính nồng độ mol chất còn lại trong nước lọc. Cho rằng thể tích nước lọc thu được không thay đổi đáng kể
Hướng dẫn giải
- Theo bài ra, ta có: nCaCl = 5,85/58,5 = 0,1 (mol). nAgNO3 = 34/170 = 0,2 (mol).
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
– Theo PTPƯ: nAgNO3 pư = nAgCl = nNaCl = 0,1 (mol)
b) Ta có: Vdd = 300 + 200 = 500 (ml).
nAgNO3 dư = 0,2 – 0, 1 = 0,1 (mol); nNaNO3 = nNaCl = 0,1 (mol).
⇒ CM (NaNO3) = CM (AgNO3) = 0,1/0,5 = 0,2 (mol/l).
Luyện tập Bài 22 Hóa 10 KNTT
Sau bài học này, học sinh có thể:
- Nhận xét và giải thích được xu hướng biến đổi nhiệt độ sôi của các hydrogen halide từ HCl tới HI. Giải thích được sự bất thường về nhiệt độ sôi của HF so với các HX khác.
- Trình bày được xu hướng biến đổi tính acid của dãy hydrohalic acid.
- Thực hiện được thí nghiệm phân biệt các ion F-, Cl-, Br-,I-.
- Trình bày được tính khử của các ion halide (Cl-, Br-,I-) thông qua phản ứng với chất oxi hoá là sulfuric add đặc
- Nêu được ứng dụng của một số hydrogen halide.
3.1. Trắc nghiệm Bài 22 Hóa 10 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Kết nối tri thức Bài 22 cực hay có đáp án và lời giải chi tiết.
-
- A. NaF và NaCl.
- B. NaCl và NaBr.
- C. NaBr và NaI.
- D. Cả 2 trường hợp đều đúng.
-
- A. 0,98 mg.
- B. 1,96 mg.
- C. 0,89 mg.
- D. 1,77 mg
-
- A. Xuất hiện kết tủa trắng.
- B. Dung dịch Br2 mất màu.
- C. Dung dịch Br2 mất màu, xuất hiện kết tủa trắng và có khí màu vàng thoát ra.
- D. Dung dịch Br2 mất màu và xuất hiện kết tủa trắng.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 22 Hóa 10 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Kết nối tri thức Bài 22 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 113 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 113 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 3 trang 113 SGK Hóa học 10 Kết nối tri thức - KNTT
Hoạt động 1 trang 113 SGK Hóa học 10 Kết nối tri thức - KNTT
Hoạt động 2 trang 114 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 4 trang 114 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 5 trang 114 SGK Hóa học 10 Kết nối tri thức - KNTT
Hoạt động trang 115 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 6 trang 116 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 7 trang 116 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 8 trang 116 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.1 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.2 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.3 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.4 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.5 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.6 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.7 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.8 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.9 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.10 trang 68 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.11 trang 69 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.12 trang 69 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.13 trang 69 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.14 trang 69 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.15 trang 69 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.16 trang 69 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.17 trang 69 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.18 trang 69 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.19 trang 70 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.20 trang 70 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.21 trang 70 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.22 trang 70 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.23 trang 70 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 22.24 trang 71 SBT Hóa học 10 Kết nối tri thức - KNTT
Hỏi đáp Bài 22 Hóa học 10 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





