Chúng ta đã biết một loại liên kết hóa học được hình thành bằng lực hút tĩnh điện giữa các ion trái dấu, hôm nay chúng ta sẽ nghiên cứu loại liên kết được hình thành do sự góp chung electron để dùng chung. Đó là liên kết cộng hóa trị.
Tóm tắt lý thuyết
1.1. Sự hình thành liên kết cộng hóa trị
1.1.1. Liên kết cộng hóa trị hình thành giữa các nguyên tử giống nhau. Sự hình thành đơn chất.
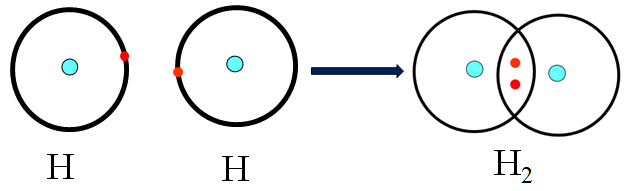
Sự hình thành phân tử H2
- Hai nguyên tử H góp 1 electron tạo thành một cặp electron chung trong phân tử H2.
- Công thức H:H được gọi là công thức electron.
- Công thức H-H gọi là công thức cấu tạo.
Hình 1: Sự hình thành phân tử H2
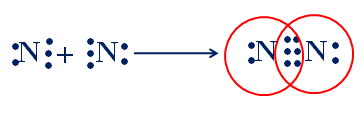
Sự hình thành phân tử nitơ
- Mỗi nguyên tử N góp chung 3e để tạo thành 3 cặp e chung của phân tử N2.
Hình 2: Sự hình thành phân tử N2
-
3 cặp electron liên kết biểu diễn bằng ba gạch (\(\equiv\)), đó là liên kết ba. Liên kết ba bền hơn liên kết đôi và liên kết đơn. Ở nhiệt độ thường N2 kém hoạt động hóa học.
-
CTCT: \(N \equiv N\)
Kết luận
- Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị.
-
Trong các phân tử H2, N2 tạo nên từ hai nguyên tử của cùng một nguyên tố nên cặp electron chung không bị hút về phía nào. Đó là liên kết cộng hóa trị không cực.
1.1.2. Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất.
Sự hình thành phân tử hyđro clorua (HCl)
- Cấu hình electron của H và Cl là:
\(\begin{array}{l} {}_1H:1{s^1}\\ {}_{17}Cl:1{s^2}2{s^2}2{p^6}3{s^2}3{p^5}\; \end{array}\)
- Nhận xét: Nguyên tử H có 1e ở lớp ngoài cùng, còn thiếu 1e để đạt cấu hình electron bền của khí hiếm He. Nguyên tử Cl có 7e ở lớp ngoài cùng, còn thiếu 1e để có vỏ bền kiểu Ar.
-
Mỗi nguyên tử H và Cl góp chung 1e để tạo thành 1 liên kết cộng hóa trị.
Hình 3: Sự hình thành phân tử HCl
- CTCT: H – Cl
-
Giá trị độ âm điện của Cl lớn hơn độ âm điện của H nên cặp e liên kết bị lệch về phía nguyên tử Cl. Liên kết cộng hóa trị này bị phân cực.
- Cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
Sự hình thành phân tử khí cacbon đioxit (CO2)
- Cấu hình electron của H và Cl là:
\(\begin{array}{*{20}{l}} {{}_6C:{\rm{ }}1{s^2}2{s^2}2{p^2}}\\ {{}_8O:{\rm{ }}1{s^2}2{s^2}2{p^4}} \end{array}\)
-
Trong phân tử CO2, nguyên tử C nằm giữa 2 nguyên tử O và nguyên tử C góp chung với mỗi nguyên tử O hai electron.
Hình 4: Sự hình thành phân tử CO2
- Trong phân tử CO2 các cặp electron bị hút lệch về phía O vì oxi có độ âm điện lớn hơn C → Liên kết C=O bị phân cực về phía O
-
Trong phân tử CO2 có cấu tạo thẳng nên liên kết đôi phân cực (C=O) triệt tiêu nhau → Phân tử CO2 không phân cực
1.1.3. Tính chất của các chất có liên kết cộng hóa trị
- Tên các chất mà phân tử chỉ có liên kết cộng hóa trị:
-
Các chất rắn: đường, lưu huỳnh, iot,..
-
Các chất lỏng: nước, rượu, xăng, dầu,…
-
Các chất khí: CO2, Cl2, H2,…
-
-
Tính chất của các chất có liên kết cộng hóa trị:
- Các chất có cực như: etanol, đường,… tan nhiều trong dung môi có cực như nước.
- Phần lớn các chất không cực như: S, I2, các chất hữu cơ không cực tan trong dung môi không cực.
- Kết luận: Các chất có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
1.2. Độ âm điện và liên kết hóa học
1.2.1. Quan hệ giữa liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực và liên kết ion
- Trong phân tử, nếu cặp electron chung ở giữa 2 nguyên tử liên kết ta có liên kết cộng hóa trị không cực.
- Nếu cặp electron chung lệch về một nguyên tử thì đó là liên kết cộng hóa trị có cực.
- Nếu cặp electron chung lệch hẳn về một nguyên tử ta sẽ có liên kết ion.
1.2.2. Hiệu độ âm điện và liên kết hóa học
| Hiệu độ âm điện \(\Delta \chi\) | Loại liên kết |
| \(0 \le \Delta \chi < 0,4\) |
Liên kết cộng hóa trị không cực |
| \(0,4 \le \Delta \chi < 1,7\) |
Liên kết cộng hóa trị có cực |
| \(\Delta \chi \ge 1,7\) | Liên kết ion |
- Trong NaCl: \(\Delta \chi = {\rm{ }}3,16{\rm{ }}-{\rm{ }}0,93{\rm{ }} = {\rm{ }}2,23{\rm{ }} > {\rm{ }}1,7\) → liên kết giữa Na và Cl là liên kết ion.
- Trong HCl: \(\Delta \chi = {\rm{ }}3,16{\rm{ }}-{\rm{ }}2,2{\rm{ }} = {\rm{ }}0,96{\rm{ }} \to {\rm{ }}0,4 \le \Delta \chi \le 1,7\) → liên kết giữa H và Cl là liên kết cộng hóa trị có cực.
- Trong H2: \(\Delta \chi = {\rm{ }}2,2{\rm{ }}-{\rm{ }}2,2{\rm{ }} = {\rm{ }}0{\rm{ }} \to {\rm{ }}0 \le \Delta \chi \le 0,4\)
Bài tập minh họa
Bài 1:
So sánh những điểm giống nhau, khác nhau giữa liên kết cộng hóa trị không cực và liên kết cộng hóa trị có cực.
Hướng dẫn:
|
Liên kết cộng hóa trị |
||
|
Không cực |
Có cực |
|
|
Đặc điểm liên kết |
Giữa Phi kim - Phi kim | |
| Hình thành liên kết |
Góp chung các electron. |
|
| Bản chất liên kết |
Cặp electron chung không bị lệch về phía nguyên tử nào. |
Cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn. |
Bài 2:
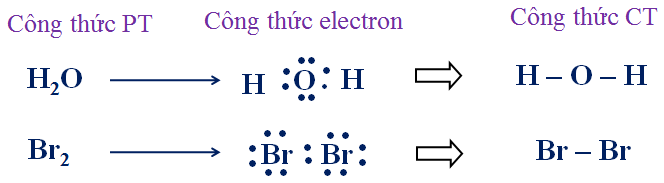
Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: Br2, H2O.
Hướng dẫn:
3. Luyện tập Bài 13 Hóa học 10
Sau bài học cần nắm:
- Công thức electron, công thức cấu tạo của một số phân tử cụ thể
- Dự đoán được kiểu liên kết hoá học có thể có trong phân tử gồm hai nguyên tử khi biết hiệu độ âm đỉện của chúng.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 13 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Liên kết ion
- B. Liên kết kim loại
- C. Liên kết cộng hoá trị
- D. Liên kết hidro
-
- A. NH3
- B. HCl
- C. O2
- D. H2O
-
- A. NH4Cl.
- B. H2O.
- C. NaCl.
- D. Ca(NO3)2.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 13.
Bài tập 1 trang 64 SGK Hóa học 10
Bài tập 2 trang 64 SGK Hóa học 10
Bài tập 3 trang 64 SGK Hóa học 10
Bài tập 4 trang 64 SGK Hóa học 10
Bài tập 5 trang 64 SGK Hóa học 10
Bài tập 6 trang 64 SGK Hóa học 10
Bài tập 7 trang 64 SGK Hóa học 10
Bài tập 13.1 trang 32 SBT Hóa học 10
Bài tập 13.2 trang 32 SBT Hóa học 10
Bài tập 13.3 trang 32 SBT Hóa học 10
Bài tập 13.4 trang 32 SBT Hóa học 10
Bài tập 13.5 trang 32 SBT Hóa học 10
Bài tập 13.6 trang 33 SBT Hóa học 10
Bài tập 13.7 trang 33 SBT Hóa học 10
Bài tập 13.8 trang 33 SBT Hóa học 10
Bài tập 13.9 trang 33 SBT Hóa học 10
Bài tập 13.10 trang 33 SBT Hóa học 10
Bài tập 13.11 trang 33 SBT Hóa học 10
Bài tập 13.12 trang 33 SBT Hóa học 10
Bài tập 13.13 trang 33 SBT Hóa học 10
Bài tập 13.14 trang 34 SBT Hóa học 10
Bài tập 13.15 trang 34 SBT Hóa học 10
Bài tập 13.16 trang 34 SBT Hóa học 10
Bài tập 13.17 trang 34 SBT Hóa học 10
Bài tập 13.18 trang 34 SBT Hóa học 10
Bài tập 13.19 trang 34 SBT Hóa học 10
Bài tập 13.20 trang 34 SBT Hóa học 10
Bài tập 13.21 trang 34 SBT Hóa học 10
Bài tập 13.22 trang 34 SBT Hóa học 10
Bài tập 13.23 trang 34 SBT Hóa học 10
Bài tập 1 trang 75 SGK Hóa học 10 nâng cao
Bài tập 2 trang 75 SGK Hóa học 10 nâng cao
Bài tập 3 trang 75 SGK Hóa học 10 nâng cao
Bài tập 4 trang 75 SGK Hóa học 10 nâng cao
Bài tập 5 trang 75 SGK Hóa học 10 nâng cao
Bài tập 6 trang 75 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 13 Chương 3 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.