HOC247 xin giới thiệu đến quý thầy cô giáo và các em học sinh nội dung Đề thi học sinh giỏi môn Hóa học 8- Phòng GD & ĐT Thanh Thủy có đáp án dưới đây. Tài liệu gồm các bài tập có phương pháp và hướng dẫn giải chi tiết sẽ giúp các em ôn tập thật tốt kiến thức, củng cố kỹ năng làm bài tập hiệu quả. Mời các em cùng tham khảo.
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO THANH THỦY
ĐỀ THI HỌC SINH GIỎI CẤP HUYỆN
MÔN HÓA HỌC 8
THỜI GIAN: 150 PHÚT
I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (10 điểm). Chọn câu trả lời đúng và làm vào tờ giấy thi.
Câu 1. Những chất nào sau đây phản ứng với nước ở điều kiện thường:
A. K, Ca, BaO, P2O5 B. FeO, Al, CuO, BaO
C. P2O5, MgO, CO2, Na D. BaO, K2O, Na, SO2
Câu 2. Cho các kim loại Cu, Mg, Fe, Zn có cùng khối lượng tác dụng với dung dịch HCl dư. Kim loại nào phản ứng cho được nhiều khí hiđro hơn:
A. Zn B. Fe C. Cu D. Mg
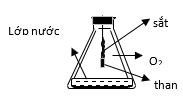
Câu 3. Phản ứng của Fe với Oxi như hình vẽ sau:Vai trò của lớp nước ở đáy bình là:
A. Giúp cho phản ứng của Fe với Oxi xảy ra dễ dàng hơn.
B. Hòa tan Oxi để phản ứng với Fe trong nước.
C.Tránh vỡ bình vì phản ứng tỏa nhiệt mạnh
D. Cả 3 vai trò trên.
Câu 4. Chất X cháy trong oxi. Đốt cháy hoàn toàn chất X rồi dẫn sản phẩm thu được vào nước vôi trong dư thu được kêt tủa trắng. X có thể là:
A. CH4 B. CO2 C. P D. C
Câu 5. Cho luồng khí CO đi qua ống sứ đựng 20 gam bột CuO nung nóng. Sau một thời gian thấy khối lượng chất rắn trong ống sứ còn lại 16,8 gam. Phần trăm khối lượng CuO đã bị khử là:
A. 60% B. 70% C. 75% D. 80%
Câu 6: Một mẫu khí thải công nghiệp có chứa các khí: CO2, SO2, NO2, H2S. Để loại bỏ các khí đó một cách hiệu quả nhất, có thể dùng dung dịch nào sau đây?
A. NaOH. B. HCl. C. Ca(OH)2. D. CaCl2.
Câu 7. Cho hỗn hợp A gồm Fe và Fe2O3. Chi hỗn hợp làm 2 phần bằng nhau:
- Phần 1: Ngâm trong dung dịch HCl dư, sau phản ứng thu được 0,672 lít khí H2 (đktc)
- Phần 2: Đun nóng sau đó cho khí H2 dư đi qua thì thu được 2,8 gam Fe.
Thành phần phần trăm theo khối lượng của Fe2O3 trong hỗn hợp đầu gần đúng nhất với giá trị nào sau đây:
A. 61,9% B. 48,8% C. 41,9% D. 70%
Câu 8: Cho biết công thức hóa học hợp chất của nguyên tố X với S và hợp chất của nguyên tố Y với hiđro như sau (X, Y là những nguyên tố nào đó) lần lượt là X2S3, YH3.
Công thức hóa học đúng cho hợp chất của X với Y là
A. XY. B. X3Y2. C. X3Y. D. X2Y3.
Câu 9: Cho các oxit có công thức hóa học như sau: SO3 (1), N2O5 (2), CO2 (3), Fe2O3 (4), CuO (5), CaO (6), Mn2O7 (7). Những chất thuộc loại oxit axit là:
A. (1), (2), (3) B. (1), (2), (3), (6). C. (1), (2), (3),(7) D. (1),(2), (3),(4).
Câu 10: Hòa tan 2,5 g CuSO4.5H2O vào 150 gam dd CuSO4 2% thì thu được dd mới có nồng độ:
A. 4,2%. B.2,5%. C.3,1%. D. 3,02%.
Câu 11: Tỉ khối của khí X đối với khí hiđro là 16, tỉ khối của khí X đối với khí Y là 0,727 . Y có thể là khí nào sau đây?
A. C3H8 B. N2 C. O2. D. SO2
Câu 12: Cho phản ứng: Fe + HNO3 - > Fe(NO3)3 + NH4NO3 + H2O
Tổng hệ số tối giản của phương trình sau khi cân bằng là:
A. 46. B. 48 C. 50 D. 58
Câu 13: Đặt hai đĩa cân ở vị trí thăng bằng. Giả sử đặt lên đĩa cân A 3,75 mol NaOH và đặt lên đĩa cân B 9.1023 phân tử CaCO3. Hỏi vị trí 2 đĩa cân như thế nào :
A. Hai đĩa cân thăng bằng B. Đĩa B bị lệch xuống
C. Đĩa A bị lệch xuống D. Đĩa B bị lệch lên
Câu 14: Để tăng năng suất cho cây trồng, một nông dân đến cửa hàng phân bón để mua phân đạm. Cửa hàng có các loại phân đạm sau: NH4NO3, (NH2)2CO; (NH4)2SO4, NH4Cl. Theo em, nếu bác nông dân mua 500kg phân đạm thì nên mua loại phân đạm nào là có lợi nhất( Biết rằng phân đạm tốt có hàm lượng nitơ lớn):
A. NH4Cl B. (NH2)2CO C. (NH4)2SO4 D. NH4NO3
Câu 15. Hấp thụ hoàn toàn 2,24 lít khí CO2 (đktc) vào 75 ml dung dịch Ca(OH)2 nồng độ 1M. Sản phẩm thu được sau phản ứng gồm:
A. Chỉ có CaCO3 B. Chỉ có Ca(HCO3)2 C. CaCO3 và Ca(OH)2 D. CaCO3 và Ca(HCO3)2
Câu 16. Hòa tan 25 gam chất X vào 100gam nước được dung dịch có khối lượng riêng là 1,143 g/ml. Nồng độ phần trăm và thể tích dung dịch thu được là:
A. 20% và 109,36ml B. 10% và 109,4ml C. 20% và 120,62ml D. 18% và 109,36ml
Câu 17: Một hợp chất X có dạng Na2CO3.aH2O trong đó oxi chiếm 72,72% theo khối lượng. Công thức của X là:
A. Na2CO3.5H2O B. Na2CO3.7H2O C. Na2CO3.10H2O D. Na2CO3.12H2O
Câu 18: Thả viên Na vào cốc nước pha vài giọt phenolphtalein. Khi viên Na tan hết, màu của dung dịch sau phản ứng
A. Vẫn giữ nguyên B. Chuyển sang màu xanh C. Bị mất màu D. Chuyển sang màu hồng
Câu 19: Đốt cháy hoàn toàn m gam chất A cần 2,24 lít khí oxi (đktc) thu được sản phẩm cháy gồm CO2 và H2O. Dẫn toàn bộ sản phẩm cháy vào bình chứa dung dịch Ca(OH)2 dư thấy khối lượng bình tăng 4,2 gam đồng thời xuất hiện 7,5 gam kết tủa. Tính giá trị của m là
A. 0,8 gam B. 1 gam C. 1,5 gam D. 1,75 gam
Câu 20: Cho a gam Na tác dụng với p gam nước (dư) thu được dung dịch NaOH nồng độ x%. Cho b gam Na2O tác dụng với p gam nước (dư) cũng thu được dung dịch NaOH nồng độ x%. Biểu thức tính p theo a và b là
A. p = B. p = C. p = D. p = .
II. PHẦN TỰ LUẬN (10 điểm).
Câu 1: (2,5 điểm)
a. Cho các chất: KMnO4, SO3, Zn, CuO, KClO3, Fe2O3, P2O5, CaO, CaCO3. Hỏi trong số các chất trên, có những chất nào.
- Nhiệt phân thu được O2 ?
- Tác dụng được với H2O, với H2?
Viết các phương trình phản ứng xảy ra cho các thí nghiệm trên (ghi rõ đk phản ứng nếu có).
b. Bằng phương pháp hóa học hãy trình bày cách nhận biết các dung dịch không màu mất nhãn chứa trong các lọ sau: Dung dịch axit clohiđric, dung dịch nari hiđroxit, Natri cacbonat, nước cất và muối ăn.
c. Trong phòng thí nghiệm người ta điều chế oxi bằng cách nhiệt phân KMnO4 hoặc KClO3. Hỏi khi sử dụng khối lượng KMnO4 và KClO3 bằng nhau thì trường hợp nào thu được thể tích khí oxi nhiều hơn? (các khí đo cùng điều kiện nhiệt độ và áp suất)
Câu 2:(2 điểm)
Cho sơ đồ: M2(CO3)n + H2SO4 → M2(SO4)n + CO2↑ + H2O: (M là kim loại có hóa trị n)
a. Cân bằng phương trình hóa học trên
b. Nếu hòa tan hoàn toàn muối trên M2(CO3)n bằng một lượng dung dịch H2SO4 9,8% (vừa đủ), thu được một dung dịch muối sunfat có nồng độ bằng 14,18%. Tìm kim loại M.
Câu 3: (2 điểm)
a. Tính số nguyên tử, số phân tử có trong 4,9 gam H2SO4 nguyên chất.
b. Cần lấy bao nhiêu gam tinh thể CuSO4.5H2O và bao nhiêu gam dung dịch CuSO4 8% để điều chế được 280 gam dung dịch CuSO4 16%.
c. Một oxit kim loại có thành phần % khối lượng của oxi là 30%. Tìm công thức oxit biết kim loại trong oxit có hoá trị III.
Câu 4: (2,5 điểm)
Khử hoàn toàn 16 gam một oxit sắt (dạng bột) bằng khí CO ở nhiệt độ cao. Người ta nhận thấy lượng CO2 sinh ra vượt quá lượng CO cần dùng là 4,8 gam. Cho lượng chất rắn thu được sau phản ứng hòa tan trong dung dịch H2SO4 0,5M (vừa đủ), thu được V lít khí (đktc). Dẫn từ từ V lít khí đó đến khi hết qua 20 gam bột CuO nung nóng, thu được a gam chất rắn.
a, Hãy xác định công thức oxit sắt.
b, Tính V và thể tích dung dịch H2SO4 cần dùng.
c, Tính a.
---Để xem đầy đủ nội dung và đáp án của đề thi các em vui lòng xem online hoặc tải về máy---
Trên đây là trích dẫn một phần nội dung tài liệu Đề thi học sinh giỏi môn Hóa học 8- Phòng GD & ĐT Thanh Thủy có đáp án. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Ngoài ra các em học sinh có thể tham khảo các tài liệu cùng chuyên mục:
- Đề thi học sinh giỏi môn Hóa học 8- Phòng GD & ĐT Phù Ninh có đáp án
- Đề thi học sinh giỏi môn Hóa học 9- Phòng GD & ĐT Thanh Oai có đáp án
Chúc các em học tốt!
Tư liệu nổi bật tuần
- Xem thêm
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)