Dưới đây là Bộ 5 đề thi giữa HK2 môn Hóa học 12 năm 2021 Trường THPT Lâm Hà. Đề thi gồm có các câu trắc nghiệm có đáp án sẽ giúp các em ôn tập nắm vững các kiến thức, các dạng bài tập để chuẩn bị cho kỳ thi sắp đến. Các em xem và tải về ở dưới.
|
TRƯỜNG THPT LÂM HÀ |
ĐỀ THI GIỮA HỌC KÌ 2 MÔN HÓA HỌC 12 THỜI GIAN 45 PHÚT |
ĐỀ SỐ 1
Câu 41. Nung m gam hỗn hợp X gồm Fe, Fe(NO3)2, Fe(NO3)3 và FeCO3 trong bình kín (không có không khí). Sau khi các phản ứng xảy ra hoàn toàn, thu được chất rắn Y và khí Z có tỉ khối so với H2 là 22,5 (giả sử khí NO2 sinh ra không tham gia phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch gồm 0,01 mol KNO3 và 0,15 mol H2SO4 (loãng), thu được dung dịch chỉ chứa 21,23 gam muối trung hoà của kim loại và hỗn hợp hai khí có tỉ khối so với H2 là 8 (trong đó có một khí hoá nâu trong không khí). Giá trị của m là ?
A. 13,92. B. 11,32. C. 13,76. D. 19,16.
Câu 42. Hòa tan m gam hỗn hợp FeO, Fe(OH)2, FeCO3 và Fe3O4( trong đó Fe3O4 chiếm 1/3 tổng số mol hỗn hợp) vào dung dịch HNO3 loãng( dư), thu được 8,96 lít (đktc) hỗn hợp gồm CO2 và NO (sản phẩm khử duy nhất của N+5) có tỉ khối so với H2 là 18,5. Số mol HNO3 phản ứng là (cho Fe=56, O=16, H=1, C=12, N=12)
A. 2,0 B. 3,2 C. 3,8 D. 1,8
Câu 43. Cho hỗn hợp Cu và Fe2O3 vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và một lượng chất rắn không tan. Muối trong dung dịch X là
A. FeCl2. B. CuCl2, FeCl2. C. FeCl2, FeCl3. D. FeCl3.
Câu 44. Nguyên tắc sản xuất gang là
A. Phân hủy các hợp chất có hàm lượng cao sắt, kém bền với nhiệt
B. Khử quặng sắt oxit bằng than cốc trong lò cao
C. Điện phân nóng chảy Fe2O3 có trộn thêm criolit
D. Giảm hàm lượng các tạp chất có trong thép bằng cách oxi hóa chúng thành oxit
Câu 45. Hợp chất sắt (II) sunfat có công thức là :
A. Fe(OH)3. B. FeSO4. C. Fe2(SO4)3 D. Fe2O3.
Câu 46. Sục khí Cl2 vào dung dịch CrCl3 trong môi trường NaOH. Sản phẩm thu được là
A. Na2CrO4, NaCl, H2O B. Na2CrO4, NaClO, H2O
C. NaCrO, NaCl, NaClO, H2O D. NaCrO2, NaCl, H2O
Câu 47. Để hoà tan hoàn toàn 2,32 gam hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3), cần dùng vừa đủ V lít dung dịch HCl 1M. Giá trị của V là (Cho Fe=56, O=16)
A. 0,16. B. 0,08. C. 0,18. D. 0,23.
Câu 48. Số oxi hóa của crom trong hợp chất CrCl3 là
A. +3 . B. +4 . C. +6 . D. +2 .
Câu 49. Chất có tính oxi hoá nhưng không có tính khử là
A. FeCl2. B. Fe. C. FeO. D. Fe2O3.
Câu 50. Cho sơ đồ chuyển hoá: Fe FeCl3 Fe(OH)3 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
A. HCl, Al(OH)3. B. Cl2, Cu(OH)2. C. Cl2, NaOH. D. HCl, NaOH.
Câu 51. Cr2O3 thuộc loại oxit
A. Bazơ B. Lưỡng tính C. Axit D. Trung tính
Câu 52. Từ 1 tấn quặng hematit (A) điều chế được 420kg sắt. Từ 1 tấn quặng manhetit (B) điều chế được 504kg sắt. Để được 1 tấn quặng hỗn hợp mà từ 1 tấn quặng hỗn hợp này điều chế được 480kg sắt thì phải trộn 2 quặng A, B với tỉ lệ về khối lượng là
A. 3 : 4 B. 2 : 5 C. 1 : 3 D. 3 : 5
Câu 53. Phân hủy Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn là
A. Fe(OH)2. B. Fe3O4. C. FeO. D. Fe2O3.
Câu 54. Khi cho 100gam hợp kim gồm có Fe, Cr và Al tác dụng với lượng dư dung dịch NaOH thu được 6,72 lít khí. Lấy phần rắn không tan cho tác dụng với lượng dư dung dịch HCl nóng (khi không có không khí) thu được 38,08 lít khí. Các thể tích khí đều đo ở đktc. Phần trăm khối lượng của Fe trong hợp kim là (Cho Fe=56. Cr=52, Al=27)
A. 80,5%. B. 86,8%. C. 87,6%. D. 85,4%.
Câu 55. Hợp chất nào sau đây của sắt vừa có tính oxi hóa, vừa có tính khử ?
A. Fe(NO3)3 B. FeO C. Fe2O3 D. Fe(OH)3
Câu 56. Nếu cho dung dịch FeCl3 vào dung dịch NaOH thì xuất hiện kết tủa màu
A. xanh lam. B. nâu đỏ. C. trắng xanh. D. vàng nhạt.
Câu 57. Gang là hợp kim của sắt với nguyên tố
A. Lưu huỳnh B. Kẽm C. Cacbon D. Nhôm
Câu 58. Hòa tan 2,32g Fe3O4 bằng dung dịch H2SO4 loãng, dư thì thu được dung dịch X. Khối lượng Cu tối đa có thể bị hòa tan trong X là (Cho Fe=56, O=16, Cu=64):
A. 3,2g. B. 0,32g. C. 0,64g. D. 0,48g.
Câu 59. Cho 5,6 gam bột Fe tác dụng vừa đủ với dung dịch HCl tạo ra dung dịch A, Cho dung dịch A vào dung dịch AgNO3 dư thì thu được bao nhiêu gam kết tủa?
A. 39,5g B. 38,1g C. 28,7g D. 10,8g
Câu 60. Cho ít bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm
A. Fe(NO3)3, AgNO3 dư. B. Fe(NO3)2, H2O.
C. Fe(NO3)2, Fe(NO3)3, AgNO3 dư. D. Fe(NO3)2, AgNO3 dư
Câu 61. Cho dãy các chất: Fe, FeO, Fe2O3, Fe(OH)2, Fe(OH)3. Số chất trong dãy khi tác dụng với dung dịch HNO3 loãng sinh ra sản phẩm khí ( chứa nitơ) là
A. 2. B. 5. C. 3. D. 4
Câu 62. Khi cho 5,6g Fe tác dụng hoàn toàn với 250 ml dung dịch AgNO3 1M thì thu được bao nhiêu gam kết tủa?
A. 37,0g B. 21,6g C. 20,7g D. 27,0g
Câu 63. Hỗn hợp chất rắn A gồm 16 gam Fe2O3 và 23.2 gam Fe3O4. Hoà tan hoàn toàn A bằng dung dịch HCl dư thu được dung dịch B. Cho NaOH dư vào B, thu được kết tủa C. Lọc lấy kết tủa, rữa sạch rồi đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn D. Giá trị m là (Cho Fe=56, O=16):
A. 16 gam. B. 80 gam. C. 40 gam D. 32.8 gam.
Câu 64. Nguyên tử Fe có cấu hình electron: 1s2 2s22p6 3s23p63d6 4s2. Vậy nguyên tố Fe thuộc họ nào?
A. họ p B. họ s C. họ d D. họ f
Câu 65. Oxit nào sau đây tác dụng với dung dịch HCl sinh ra hỗn hợp muối?
A. Na2O. B. Al2O3. C. Fe3O4. D. CaO.
Câu 66. Cấu hình electron của ion Cr3+ là
A. [Ar]3d2. B. [Ar]3d5. C. [Ar]3d4. D. [Ar]3d3.
Câu 67. Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3H2SO4(loãng) → Fe2(SO4)3 + 3H2.
B. 4Cr + 3O2 → 2Cr2O3.
C. Ca + 2H2O → Ca(OH)2 + H2.
D. 2Al + Fe2O3 → Al2O3 + 2Fe.
Câu 68. Cho luồng khí CO vào 32g bột Fe2O3 nung nóng ở nhiệt độ cao, sau phản ứng thu được m gam hỗn hợp (Fe, Fe3O4, FeO, Fe2O3) và hỗn hợp khí A. Cho hỗn hợp khí A vào dung dịch Ca(OH)2 dư thì thu được 30g kết tủa. Giá trị của m là
A. 32,7g B. 32,0g C. 27,2g D. 18,7g
Câu 69. Cho các phát biểu sau:
(a) Cr và Cr(OH)3 đều có tính lưỡng tính và tính khử.
(b) Cr2O3 và CrO3 đều là chất rắn, màu lục, không tan trong nước.
(c) H2CrO4 và H2Cr2O7 đều chỉ tồn tại trong dung dịch.
(d) CrO3 và K2Cr2O7 đều có tính oxi hoá mạnh.
Số phát biểu đúng là
A. 3. B. 2. C. 4. D. 1.
Câu 70. Công thức hóa học của kali đicromat là
A. K2CrO4 B. KMnO4 C. K2Cr2O7 D. KCrO4
Câu 71. Cho phản ứng: FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 +H2O. Trong phản ứng trên, chất oxi hóa và chất khử lần lượt là
A. K2Cr2O7 và FeSO4. B. FeSO4 và K2Cr2O7.
C. H2SO4 và FeSO4. D. K2Cr2O7 và H2SO4.
Câu 72. Cấu hình của ion Fe3+ là:
A. 1s22s22p63s23p63d5 B. 1s22s22p63s23p63d64s1
C. 1s22s22p63s23p63d6 D. 1s22s22p63s23p63d64s2
ĐÁP ÁN ĐỀ SỐ 1
|
41 |
C |
49 |
D |
57 |
C |
65 |
C |
|
42 |
B |
50 |
C |
58 |
C |
66 |
D |
|
43 |
B |
51 |
B |
59 |
A |
67 |
A |
|
44 |
B |
52 |
B |
60 |
A |
68 |
C |
|
45 |
B |
53 |
D |
61 |
C |
69 |
B |
|
46 |
A |
54 |
B |
62 |
D |
70 |
C |
|
47 |
B |
55 |
B |
63 |
C |
71 |
A |
|
48 |
A |
56 |
B |
64 |
D |
72 |
A |
ĐỀ SỐ 2
Câu 31. Nhôm bền trong môi trường không khí và nước là do
A. nhôm là kim loại kém hoạt động.
B. nhôm có tính thụ động với không khí và nước.
C. có màng oxit Al2O3 bền vững bảo vệ.
D. có màng hiđroxit Al(OH)3 bền vững bảo vệ.
Câu 32. Nhôm oxit (Al2O3) không phản ứng được với dung dịch
A. NaOH. B. NaCl. C. HNO3. D. H2SO4.
Câu 33. Cho 16,15g hỗn hợp MCl và MBr tác dụng hoàn toàn với dung dịch AgNO3 dư thì thu được 33,15 gam kết tủa. M là:
A. Na. B. Li. C. Rb. D. K.
Câu 34. Ở nhiệt độ cao, Al khử được ion kim loại trong oxit
A. Na2O. B. Fe3O4. C. MgO. D. CaO.
Câu 35. Cho dd chứa các Ion sau: Na+, Ca2+,Ba2+ , H+, Cl-. Muốn tách được nhiều Kation ra khỏi dd mà không đưa Ion lạ vào dd, ta có thể cho dd tác dụng với chất nào trong các chất sau:
A. dd NaOH vừa đủ B. dd K2CO3 vừa đủ C. dd Na2SO4 vừa đủ D. dd Na2CO3 vừa đủ
Câu 36. Chất làm mềm nước có tính cứng toàn phần là
A. Na2CO3 B. CaSO4 C. NaCl D. CaCO3
Câu 37. Cho 150 ml dung dịch AlCl3 2 M tác dụng với V lít dung dịch KOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là (cho Al=27, O=16, H=1)
A. 2,4. B. 1,2. C. 1,8. D. 2.
Câu 38. Trong tự nhiên,canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
A. Thạch cao nung B. Đá vôi C. Thạch cao sống D. Thạch cao khan
Câu 39. Dãy gồm các chất vừa tan trong dung dịch HCl, vừa tan trong dung dịch NaOH là:
A. NaHCO3, ZnO, Mg(OH)2. B. Mg(OH)2, Al2O3, Ca(HCO3)2.
C. NaHCO3, Ca(HCO3)2, Al2O3. D. NaHCO3, MgO, Ca(HCO3)2.
Câu 40. Hoà tan hoàn toàn 2,9 gam hỗn hợp gồm kim loại M và oxit của nó vào nước, thu được 500 ml dung dịch chứa một chất tan có nồng độ 0,04M và 0,224 lít khí H2 (ở đktc). Kim loại M là (cho Na=23, Ca=40, Ba=137, K=39)
A. Ca. B. K. C. Ba. D. Na.
Câu 41. Dãy chỉ gồm các kim loại kiềm là
A. Li, Na, K , Ba B. Na, K, Rb, Cs C. Li, Na, Be, K D. Na, K, H, Li
Câu 42. Nhỏ từ từ đến dư dung dich NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là:
A. Có kết tủa keo trắng và có khí bay lên.
B. Có kết tủa keo trắng sau đó kết tủa tan.
C. Không có kết tủa keo trắng có khí bay lên.
D. Chỉ có kết tủa keo trắng.
Câu 43. Kim loại có thể tạo peoxit là:
A. Na B. Mg C. Fe D. Al
Câu 44. Để điều chế Al từ Al2O3 khan người ta dùng phương pháp
A. điện phân nóng chảy Al2O3.
B. cho tác dụng HCl rồi điện phân dung dịch thu được.
C. dùng Na khử Al2O3 ở nhiệt độ cao.
D. nung muối Al2O3 ở nhiệt độ cao.
Câu 45. Câu nào sau đây về nước cứng là không đúng
A. Nước cứng có chứa đồng thời Ca2+ , Mg2+ anion HCO3- và SO42- hoặc Cl- là nước cứng toàn phần
B. Nước có chứa nhiều ion Ca2+, Mg2+
C. Nước cứng có chứa 1 trong 2 ion Cl- và SO42- hoặc cả 2 là nước cứng tạm thời
D. Nước không chứa hoặc chứa ít ion Ca2+ , Mg2+ là nước mềm
---(Nội dung chi tiết từ câu 46 đến câu 62 của đề thi số 2 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 2
|
31 |
C |
39 |
C |
47 |
B |
55 |
A |
|
32 |
B |
40 |
C |
48 |
D |
56 |
B |
|
33 |
A |
41 |
B |
49 |
B |
57 |
D |
|
34 |
B |
42 |
B |
50 |
B |
58 |
A |
|
35 |
D |
43 |
A |
51 |
D |
59 |
A |
|
36 |
A |
44 |
A |
52 |
D |
60 |
A |
|
37 |
D |
45 |
C |
53 |
A |
61 |
B |
|
38 |
C |
46 |
A |
54 |
A |
62 |
C |
ĐỀ SỐ 3
Câu 41. Hợp chất hữu cơ tham gia phản ứng tráng gương là
A. CH3COOH. B. CH3COOCH3. C. CH3CHO. D. C2H5OH.
Câu 42. Metyl fomat có công thức là
A. CH3COOC2H5. B. HCOOCH3. C. CH3COOCH3. D. HCOOC2H5.
Câu 43. Chất nào sau đây không tham gia phản ứng thủy phân?
A. Chất béo. B. Saccarozơ. C. Xenlulozơ. D. Fructozơ.
Câu 44. Thạch cao nung được dùng để bó bột, nặn tượng có công thức là
A. CaSO4.2H2O. B. CaSO4. C. CaO. D. CaSO4.H2O.
Câu 45. Chất NH2CH2COOH có tên gọi là
A. Lysin. B. Valin. C. Glyxin. D. Alanin.
Câu 46. Cho sơ đồ phản ứng: KHCO3 + X → K2CO3 + H2O. X là hợp chất
A. KOH. B. NaOH. C. K2CO3. D. HCl.
Câu 47. Chất nào sau đây là chất điện li mạnh?
A. NaNO3. B. C12H22O11. C. CaSO4. D. H2O.
Câu 48. Phèn chua là muối sunfat kép của nhôm và kim loại kiềm ngậm nước. Công thức của kim loại kiềm trong phèn chua là
A. Li. B. Na. C. K. D. Rb.
Câu 49. Chất nào sau đây tác dụng với dung dịch HCl giải phóng khí CO2?
A. Fe2O3. B. Fe. C. FeCO3. D. Fe(OH)2.
Câu 50. Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư, thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có chứa khí nào sau đây?
A. CO2. B. NH3. C. SO2. D. H2S.
---(Nội dung chi tiết từ câu 51 đến câu 80 của đề thi số 3 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 3
|
41 |
C |
51 |
B |
61 |
A |
71 |
A |
|
42 |
B |
52 |
D |
62 |
D |
72 |
B |
|
43 |
D |
53 |
C |
63 |
A |
73 |
A |
|
44 |
D |
54 |
D |
64 |
B |
74 |
B |
|
45 |
C |
55 |
D |
65 |
C |
75 |
B |
|
46 |
A |
56 |
A |
66 |
B |
76 |
A |
|
47 |
A |
57 |
B |
67 |
D |
77 |
C |
|
48 |
C |
58 |
B |
68 |
A |
78 |
A |
|
49 |
C |
59 |
C |
69 |
C |
79 |
B |
|
50 |
D |
60 |
D |
70 |
D |
80 |
C |
ĐỀ SỐ 4
Câu 31. Chỉ dùng thêm một hóa chất hãy nhận biết các kim loại Cu, Al, Ba trong các bình mất nhãn:
A. AgNO3 B. HCl C. H2O D. NaOH
Câu 32. Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 1,12 lít khí H2 (đktc) và dung dịch Y, trong đó có 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 6,72 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là (cho Na=23, Ba=137, C=12, O=16)
A. 39,40. B. 15,76. C. 23,64. D. 21,92.
Câu 33. Cho 1,56 gam hỗn hợp gồm Al và Al2O3 phản ứng hết với dung dịch HCl (dư), thu được V lít khí H2 (đktc) và dung dịch X. Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Giá trị của V là (cho Al=27, O=16, H=1)
A. 0,224. B. 0,448. C. 1,344. D. 0,672.
Câu 34. Để sát trùng, tẩy uế tạp xung quanh khu vực bị ô nhiễm, người ta thường rải lên đó những chất bột màu trắng đó là chất gì ?
A. CaO B. Ca(OH)2 C. CaCO3 D. CaOCl2
Câu 35. Hỗn hợp X gồm 2 kim loại kiềm và 1 kim loại kiềm thổ tan hết trong nước tạo ra dung dịch Y và 0,12 mol H2 .Thể tích dung dịch H2SO4 0,5M cần để trung hòa dung dịch Y là:
A. 60ml. B. 1,20 lít. C. 240ml. D. 120ml.
Câu 36. Cho m gam hỗn hợp K và Ba vào nước dư thu được dung dịch X và V lít khí (đktc). Sục từ từ đến dư khí CO2 vào X, kết quả thí nghiệm được biễu diễn trên đồ thị sau:
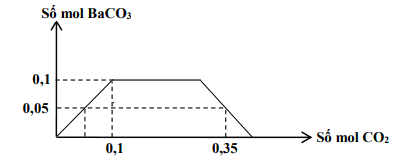
Khối lượng của K trong m gam hỗn hợp là:
A. 31,2 B. 11,7 C. 13,8 D. 7,8
Câu 37. Cho dung dịch NaOH dư vào dung dịch có CuCl2, FeCl2, AlCl3. Lọc lấy kết tủa, đem nung trong không khí đến khối lượng không đổi thu được chất rắn X. Chất rắn X gồm:
A. Fe2O3, NaCl. B. CuO, Fe2O3, NaCl.
C. CuO, Fe2O3 D. CuO, FeO, Al2O3.
Câu 38. Chất không có tính chất lưỡng tính là:
A. Al2O3. B. AlCl3. C. Al(OH)3. D. NaHCO3.
Câu 39. Kim loại có thể tạo peoxit là:
A. Fe B. Na C. Al D. Mg
Câu 40. Phương pháp điều chế kim loại phân nhóm chính nhóm II là :
A. Phương pháp điện phân dung dịch B. Phương pháp điện phân nóng chảy.
C. Phương pháp thủy luyện. D. Phương pháp nhiệt luyện.
---(Nội dung chi tiết từ câu 41 đến câu 62 của đề thi số 4 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 4
|
31 |
C |
39 |
B |
47 |
B |
55 |
D |
|
32 |
B |
40 |
B |
48 |
B |
56 |
A |
|
33 |
D |
41 |
C |
49 |
C |
57 |
A |
|
34 |
D |
42 |
D |
50 |
D |
58 |
B |
|
35 |
C |
43 |
D |
51 |
D |
59 |
D |
|
36 |
D |
44 |
B |
52 |
B |
60 |
C |
|
37 |
C |
45 |
C |
53 |
D |
61 |
A |
|
38 |
B |
46 |
D |
54 |
B |
62 |
D |
ĐỀ SỐ 5
Câu 41. Trong công nghiệp, Na được điều chế bằng cách điện phân nóng chảy hợp chất nào?
A. NaNO3. B. NaOH. C. NaHCO3. D. NaCl.
Câu 42. Thạch cao nung được dùng để bó bột, nặn tượng có công thức là
A. CaSO4.H2O. B. CaSO4.2H2O. C. CaSO4. D. CaO.
Câu 43. Chất nào sau đây là chất điện li mạnh?
A. NaNO3. B. H2O. C. C12H22O11. D. CaSO4.
Câu 44. Metyl fomat có công thức là
A. CH3COOC2H5. B. HCOOC2H5. C. CH3COOCH3. D. HCOOCH3.
Câu 45. Cho sơ đồ phản ứng: KHCO3 + X → K2CO3 + H2O. X là hợp chất
A. K2CO3. B. NaOH. C. HCl. D. KOH.
Câu 46. Công thức hóa học của kali hiđroxit là
A. NaOH. B. KHCO3. C. KOH. D. KCl.
Câu 47. Chất nào sau đây tác dụng với dung dịch HCl giải phóng khí CO2?
A. FeCO3. B. Fe2O3. C. Fe. D. Fe(OH)2.
Câu 48. Kim loại sắt tác dụng với dung dịch nào sau đây tạo ra muối sắt(II)?
A. MgSO4. B. CuSO4.
C. HNO3 đặc, nóng, dư. D. H2SO4 đặc, nóng, dư
Câu 49. Nhúng thanh kim loại X vào dung dịch muối CuSO4, sau một thời gian lấy thanh kim loại ra cân lại, thấy khối lượng thanh kim loại giảm m gam. Kim loại X là
A. Fe. B. Zn. C. Mg. D. Al.
Câu 50. Chất nào sau đây có tính lưỡng tính?
A. NaHCO3. B. KOH. C. Al. D. Fe(OH)2.
---(Nội dung chi tiết từ câu 51 đến câu 80 của đề thi số 5 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 5
|
41 |
D |
51 |
A |
61 |
C |
71 |
C |
|
42 |
A |
52 |
C |
62 |
B |
72 |
B |
|
43 |
A |
53 |
C |
63 |
A |
73 |
A |
|
44 |
D |
54 |
B |
64 |
D |
74 |
A |
|
45 |
D |
55 |
B |
65 |
D |
75 |
D |
|
46 |
C |
56 |
D |
66 |
C |
76 |
B |
|
47 |
A |
57 |
A |
67 |
A |
77 |
D |
|
48 |
B |
58 |
B |
68 |
C |
78 |
A |
|
49 |
B |
59 |
D |
69 |
D |
79 |
C |
|
50 |
A |
60 |
B |
70 |
B |
80 |
C |
Trên đây là một phần trích dẫn nội dung Bộ 5 đề thi giữa HK2 môn Hóa học 12 năm 2021 có đáp án Trường THPT Lâm Hà. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Ngoài ra các em có thể tham khảo thêm một số tư liệu cùng chuyên mục tại đây:
- Bộ 5 đề thi giữa HK2 môn Hóa học 12 năm 2021 có đáp án Trường THPT Nguyễn Huệ
- Bộ 5 đề thi giữa HK2 môn Hóa học 12 năm 2021 có đáp án Trường THPT Y Đôn
Chúc các em học tốt!
Tư liệu nổi bật tuần
-
Đề thi minh họa môn Hóa học tốt nghiệp THPT năm 2025
22/10/2024472 -
Đề thi minh họa môn Tin học tốt nghiệp THPT năm 2025
22/10/2024160 -
Đề thi minh họa môn Toán tốt nghiệp THPT năm 2025
22/10/2024235 - Xem thêm
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)


