Giải bài 5 tr 117 sách GK Hóa lớp 8
Cho 22,4 g sắt tác dụng với dung dịch loãng có chứa 24,5 g axit sunfuric.
a. Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b. Tính thể tích khí hiđro thu được ở đktc.
Hướng dẫn giải chi tiết bài 5
Câu a:
Số mol sắt là: n = 22,4 : 56 = 0,4 (mol)
Số mol axit sunfuric là: n = 24,5 : 98 = 0,25 (mol)
Phương trình phản ứng:
Fe + H2SO4 → FeSO4 + H2
1mol 1mol 1mol
0,25mol 0,25mol 0,25mol
Theo phương trình phản ứng hóa học, cứ 1 mol sắt tác dựng thì cần 1mol H2SO4. Do đó, 0,25 mol sắt tác dụng thì cần 0,25 mol H2SO4.
Vậy, số mol sắt dư là: ndư = 0,4 – 0,25 = 0,15 (mol)
Khối lượng sắt dư là: mdư = 0,15 x 56 = 8,4 (g)
Câu b:
Theo phương trình phản ứng hóa học, ta có: nH2 = nFe = 0,25 mol
Thể tích khí hiđro thu được ở đktc là: VH2 = 0,25 x 22,4 = 5,6 (lít)
-- Mod Hóa Học 8 HỌC247
Video hướng dẫn giải bài 5 SGK
Bài tập SGK khác
Bài tập 3 trang 117 SGK Hóa học 8
Bài tập 4 trang 117 SGK Hóa học 8
Bài tập 33.1 trang 46 SBT Hóa học 8
Bài tập 33.2 trang 47 SBT Hóa học 8
Bài tập 33.3 trang 47 SBT Hóa học 8
Bài tập 33.4 trang 47 SBT Hóa học 8
Bài tập 33.5 trang 47 SBT Hóa học 8
Bài tập 33.6 trang 47 SBT Hóa học 8
Bài tập 33.7 trang 47 SBT Hóa học 8
Bài tập 33.8 trang 48 SBT Hóa học 8
Bài tập 33.9 trang 48 SBT Hóa học 8
Bài tập 33.10 trang 48 SBT Hóa học 8
-


Phản ứng nào dưới đây có thể tạo được khí hiđro?
bởi Nguyễn Hạ Lan
 16/01/2021
16/01/2021
A. Cu + HCl
B. CaO + H2O
C. Fe + H2SO4 loãng
D. CuO + HCl
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Trong giờ thực hành hóa học, học sinh A cho 32,5 gam kẽm vào dung dịch H2SO4 loãng, trong khí đó học sinh B cho 32,5 gam sắt cũng vào dung dịch H2SO4 loãng như ở trên. Hãy cho biết học sinh A hay học sinh B thu được nhiều khí hiđro (đo ở đktc) hơn?
bởi Lê Minh Hải
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H2SO4 loãng. Hãy viết các phương trình hóa học có thể điều chế hiđro.
bởi Tieu Dong
 16/01/2021
Theo dõi (0) 1 Trả lời
16/01/2021
Theo dõi (0) 1 Trả lời -
ADMICRO


Những phản ứng hóa học nào dưới đây thường dùng để điều chế hiđro trong phòng thí nghiệm?
bởi Long lanh
 15/01/2021
15/01/2021
a. Zn + H2SO4 → ZnSO4 + H2↑
b. 2H2O điện phân→ 2H2↑ + O2↑
c. 2Al + 6HCl → 2AlCl3 + 3H2↑
d. Fe + H2SO4 → FeSO4 + H2↑
Theo dõi (0) 1 Trả lời -


Lập phương trình hóa học của các phản ứng sau và cho biết chúng thuộc loại phản ứng nào?
bởi Ha Nguyen
 17/06/2020
17/06/2020
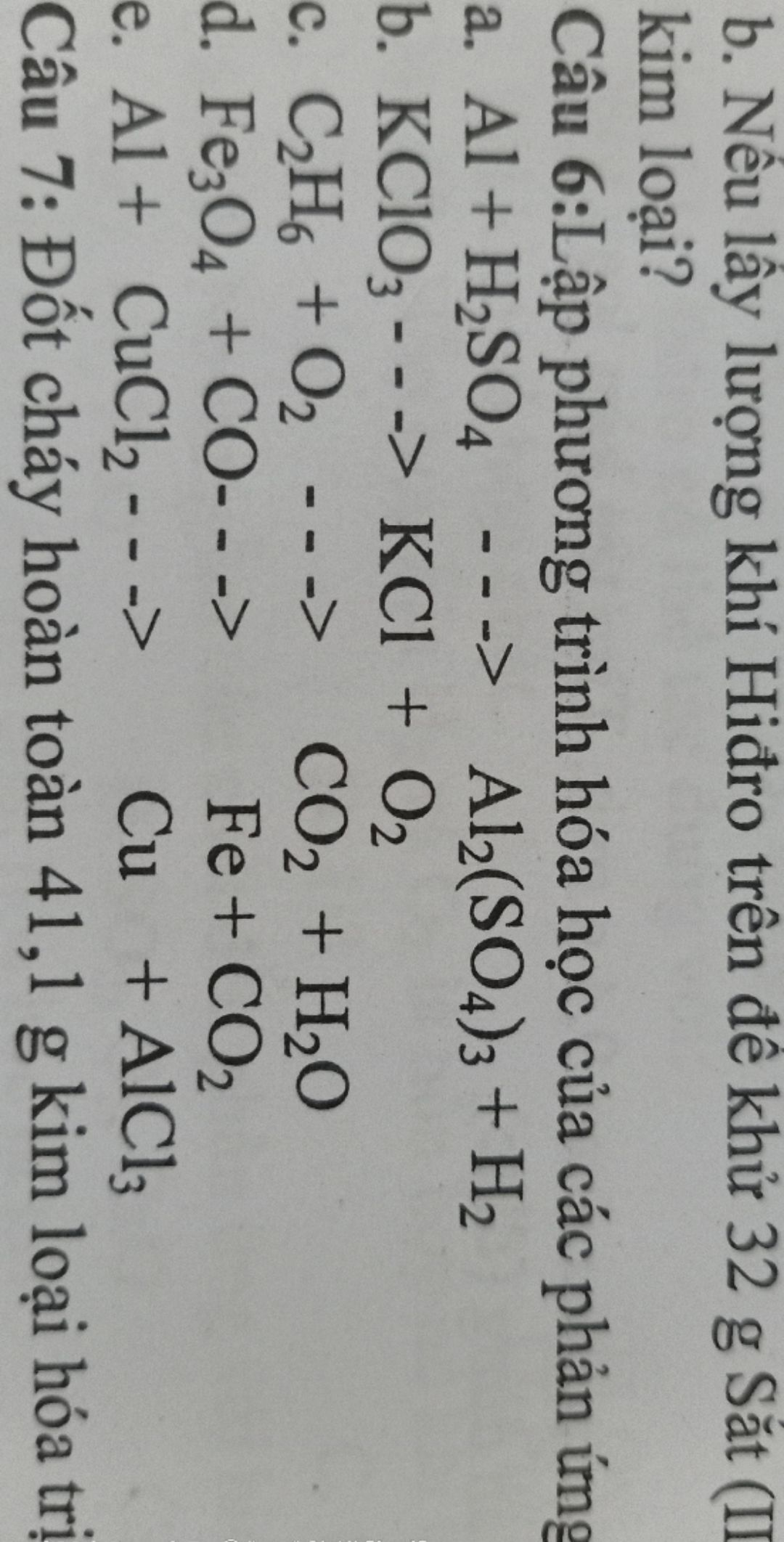 Theo dõi (0) 2 Trả lời
Theo dõi (0) 2 Trả lời -


Cho 4,6 gam kim loại natri tác dụng với nước?
bởi Duyen Hoang
 15/06/2020
Viết phản ứng phương trình hóa họcTheo dõi (0) 2 Trả lời
15/06/2020
Viết phản ứng phương trình hóa họcTheo dõi (0) 2 Trả lời -


Mô tả hiện tượng và lập phương trình phản ứng?
bởi Nguyễn Tiến
 14/06/2020
14/06/2020
Điều chế hiđro trong phòng thí nghiệm,cho kim lọa kẽm tác dụng vừa đủ với 100 gam dung dịch axit clohiđric HCL 7,3% thu được kẽm clorua ZnCl2 và khí hiđro H2
a.Mô tả hiện tượng và lập phương trình phản ứng
b.Tính khối lượng kẽm tham gia phản ứng và thể tích khí hiđro sinh ra (đktc)
c.Tính nồng độ phần trăm dung dịch thu được sau phản ứng
Theo dõi (0) 0 Trả lời -


Tính khối lượng ban đầu của Al khi cho phản ứng với axit sunfuric thấy có 1,68(l) khí thoát ra.
bởi thùy trang
 29/05/2020
29/05/2020
A. 2,025g
B. 5,24g
C. 6,075g
D. 1,35g
Theo dõi (0) 3 Trả lời -


Cho một thanh sắt nặng 5,53g vào bình đựng dung dịch axit clohidric loãng thu được dung dịch A và khí bay lên. Cô cạn dung dịch A được m (g) chất rắn. Hỏi dung dịch A là gì và tìm m
bởi Hoang Vu
 29/05/2020
29/05/2020
A. FeCl2 và m = 113,9825g
B. FeCl2 và m = 12,54125g
C. FeCl3 và m = 55,3g
D. Không xác định được
Theo dõi (0) 3 Trả lời -


A. 22,4 (l)
B. 0,224 (l)
C. 2,24 (l)
D. 4,8 (l)
Theo dõi (0) 3 Trả lời -


A. 1
B. 2
C. 3
D. 4
Theo dõi (0) 3 Trả lời -


Phản ứng nào dưới đây là phản ứng thế?
bởi Tran Truong
 29/05/2020
29/05/2020
Phản ứng nào dưới đây là phản ứng thế:

A. SO3 + H2O →H2SO4
B. 2KClO3 to → 2KCl + 3O2
C. Fe2O3 + 6HCl →2FeCl3 +3 H2O
D. Fe + 2HCl → FeCl2 + H2O
Theo dõi (0) 3 Trả lời -


Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm như thế nào?
bởi Jungkook Joen
 14/05/2020
14/05/2020
 Theo dõi (0) 2 Trả lời
Theo dõi (0) 2 Trả lời -


Cho dung dịch axit sunfuric loãng, nhôm và các dụng cụ thí nghiệm như hình 5.8. Hãy chọn câu trả lời đúng trong các câu sau?
bởi Tiết Linh Bích
 29/04/2020
Giúp mình vớiTheo dõi (0) 0 Trả lời
29/04/2020
Giúp mình vớiTheo dõi (0) 0 Trả lời -


Khối lượng Zn và Fe trong X lần lượt là?
bởi Đức Thịnh
 25/04/2020
25/04/2020
A. 9,75 gam và 16,8 gam
B. 19,5 gam và 8,4 gam
C. 14,625 gam và 12,6 gam
D. 29,25 gam và 25,2 gam
Theo dõi (0) 2 Trả lời -


Để điều chế khí hidro ở phòng thí nghiệm , người ta cho 13gam Zn tác dụng hoàn toàn với dung dịch HCl thu được ZnCl2 và khí Hidro?
bởi Tuấn Anh Striker
 23/04/2020
Câu 1 Viết PTHH Câu 2 Tính thế tích khí H2 sinh ra ở đktc Câu 3 Tính khối lượng ZnCl2 thu đượcTheo dõi (0) 0 Trả lời
23/04/2020
Câu 1 Viết PTHH Câu 2 Tính thế tích khí H2 sinh ra ở đktc Câu 3 Tính khối lượng ZnCl2 thu đượcTheo dõi (0) 0 Trả lời -


Khử 12g sắt(III) oxit bằng khí hiđro, thể tích khí hiđro(đktc) cần dùng là?
bởi Đừng quan tâm Cái avatar
 23/04/2020
23/04/2020
Câu8: Khử 12g sắt(III) oxit bằng khí hiđro, thể tích khí hiđro(đktc) cần dùng là: (Biết: Fe = 56; H = 1; O = 16) *
A. 5,04 lít
B. 7,56 lit
C. 8,2 lít
D. 10,08 lít
Câu 9: Dung dịch axit được dùng để điều chế hidro trong phòng thí nghiệm là: *
A. HCl, H2SO4 loãng
B. HCl đặc, HNO3
C. H2SO4 đặc
D. H2SO4 đặc, HNO3
Câu 10: Tính khối lượng ban đầu của Al khi cho phản ứng với axit sunfuric thấy có 1,68 lít khí thoát ra (ở đktc). (Biết: Al = 27; H = 1; S = 32; O = 16) *
A. 2,025g
B. 5,24g
C. 6,075g
D. 1,35g
Theo dõi (0) 0 Trả lời -


Thể tích khí hiđro cần dùng (ở đktc) để khử hoàn toàn 23,2 gam oxit sắt từ ở nhiệt độ cao là?
bởi Cát Tường
 22/04/2020
22/04/2020
Thể tích khí hiđro cần dùng (ở đktc) để khử hoàn toàn 23,2 gam oxit sắt từ ở nhiệt độ cao là:
Theo dõi (0) 0 Trả lời -


Cần dùng bao nhiêu gam Al tác dụng với dung dịch HCl, thì thu được 10,08 lít khí hiđro?
bởi Nguyễn Ngọc
 22/04/2020
Cần dùng bao nhiêu gam Al tác dụng với dung dịch HCl, thì thu được 10,08 lít khí hiđro (đktc): *Theo dõi (1) 0 Trả lời
22/04/2020
Cần dùng bao nhiêu gam Al tác dụng với dung dịch HCl, thì thu được 10,08 lít khí hiđro (đktc): *Theo dõi (1) 0 Trả lời -


Lập phương trình hóa học?
bởi Trương văn Công
 19/04/2020
19/04/2020
Bài 2/tr117:Lập phương trình hóa học của các sơ đồ phẩn ứng cho sau đây và cho biết chúng thuộc loại phẩn ứng nào.
a/Mg + O2 - - -> MgO
b/KMnO4 - -t-> K2MnO4 + MnO2 + O2
c/Fe + CuCl2 - - -> FeCl2 + Cu
Theo dõi (0) 1 Trả lời -


Nêu tính chất vật lý và hóa học của hiđrô?
bởi Uyển Nhi
 18/04/2020
Nêu Tính chất vật lý và hóa học của hiđrô. Viết PTHH minh hoạ. Qua đó e rút được kết luận gì về hidroTheo dõi (0) 0 Trả lời
18/04/2020
Nêu Tính chất vật lý và hóa học của hiđrô. Viết PTHH minh hoạ. Qua đó e rút được kết luận gì về hidroTheo dõi (0) 0 Trả lời -

 5. Trong các phản ứng hóa học sau, phản ứng nào là phản ứng thế? A . Fe2O3 3H2 → 2Fe 3H2O B . CaO H2O -> Ca ( OH ) 2 C . 2KMnO4 -> K2MnO4 MnO2 O2 D . BaCl2 H2SO4 -> BaSO4 2HCl 6. Hoà tan 7,2 g magie bằng dung dịch axit clohiđric. Nếu dùng thể tích H2 trên để khử hoàn toàn sắt (III) oxit thì thu được bao nhiêu gam sắt? A. 10,2 g. B. 11,2 g. C. 12,1 g. D. 12,2 g. 7. Cho 19,5g Zn tác dụng vừa đủ với dung dịch axit sunfuric loãng. Nếu dùng toàn bộ lượng hiđrô bay ra ở trên đem khử hoàn toàn 16g bột CuO ở nhiệt độ cao thì chất nào còn dư? dư bao nhiêu gam? A. CuO dư, 8 gam. B. CuO dư, 16 gam. C. H2 dư, 0,2 gam. D. H2 dư, 0,6 gam.Theo dõi (1) 0 Trả lời
5. Trong các phản ứng hóa học sau, phản ứng nào là phản ứng thế? A . Fe2O3 3H2 → 2Fe 3H2O B . CaO H2O -> Ca ( OH ) 2 C . 2KMnO4 -> K2MnO4 MnO2 O2 D . BaCl2 H2SO4 -> BaSO4 2HCl 6. Hoà tan 7,2 g magie bằng dung dịch axit clohiđric. Nếu dùng thể tích H2 trên để khử hoàn toàn sắt (III) oxit thì thu được bao nhiêu gam sắt? A. 10,2 g. B. 11,2 g. C. 12,1 g. D. 12,2 g. 7. Cho 19,5g Zn tác dụng vừa đủ với dung dịch axit sunfuric loãng. Nếu dùng toàn bộ lượng hiđrô bay ra ở trên đem khử hoàn toàn 16g bột CuO ở nhiệt độ cao thì chất nào còn dư? dư bao nhiêu gam? A. CuO dư, 8 gam. B. CuO dư, 16 gam. C. H2 dư, 0,2 gam. D. H2 dư, 0,6 gam.Theo dõi (1) 0 Trả lời -


Hoàn thành PTHH sau, gọi tên các sản phẩm?
bởi Nguyễn Quỳnh Chi
 15/04/2020
15/04/2020
Zn + H2SO4 => ...........
Al + H2SO4 -> …………………….. Pb + H2SO4 --->
Na + HCl ---> ………………………..
Ca + HCl ---> ………………………..
CuO + H2 --> ……………………… ZnO + H2 --->…………………..
PbO + H2 ---> ……………………… HgO + H2 --->……………………
Theo dõi (0) 0 Trả lời





