Mời các em học sinh cùng tham khảo nội dung bài giảng Bài 19: Tốc độ phản ứng môn Hóa học lớp 10 chương trình SGK Kết nối tri thức bên dưới đây để tìm hiểu các yếu tố ảnh hưởng đến tốc độ cũng như một số ứng dụng của chúng khi ta tiến hành thay đổi tốc độ phản ứng.
Tóm tắt lý thuyết
1.1. Tốc độ phản ứng hóa học
a. Khái niệm tốc độ phản ứng hoá học
- Khi phản ứng hoá học xảy ra, lượng chất đầu giảm dần theo thời gian, trong khi lượng chất sản phẩm tăng dần theo thời gian (Hình 19.1).
.jpg)
Hình 19.1. Sự thay đổi lượng chất theo thời gian
- Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất đầu hoặc chất sản phẩm trong một đơn vị thời gian: giây (s), phút (min). giờ (h), ngày (d),... Lượng phản ứng chất có thể được biểu diễn bằng số mol, nồng độ mol, khối lượng, hoặc thể tích.
- Các phản ứng khác nhau xảy ra với tốc độ khác nhau, có phản ứng xảy ra nhanh, có phản ứng xảy ra chậm (Hình 19.2).

Hình 19.2. Phản ứng xảy ra nhanh: a) Than chảy
Phản ứng xảy ra chậm: b) Sắt bị gi, c) Tinh bột lên men rượu
b. Tốc độ trung bình của phản ứng
- Đa số các phản ứng hoá học có tốc độ giảm dần theo thời gian. Để đặc trưng cho sự nhanh chậm của phản ứng trong một khoảng thời gian, ta dùng tốc độ phản ứng trung bình.
Ví dụ: Xét phản ứng tổng hợp NH3.
N2 + 3H2 → 2NH3
- Tại thời điểm t1, nồng độ N2, H2, NH3 lần lượt là CN2 (1), CH2 (1), CNH3 (1).
- Tại thời điểm t2, nồng độ N2, H2, NH3 lần lượt là CN2 (2), CH2 (2), CNH3 (2).
- Vậy, trong khoảng thời gian \(\Delta t = {t_2} - {t_1}\), biến thiên nồng độ các chất là:
\(\Delta {C_{{N_2}}} = {C_{{N_2}}}(2) - {C_{{N_2}}}(1)\)
\(\Delta {C_{{H_2}}} = {C_{{H_2}}}(2) - {C_{{H_2}}}(1)\)
\(\Delta {C_{{NH_3}}} = {C_{{NH_3}}}(2) - {C_{{NH_3}}}(1)\)
- Khi phản ứng xảy ra, theo thời gian, nồng độ N2 và H2 giảm, nồng độ NH3 tăng, nên \(\Delta {C_{{N_2}}}\), và \(\Delta {C_{{H_2}}}\) âm, \(\Delta {C_{{NH_3}}}\) dương.
- Từ phương trình hoá học, cho thấy tỉ lệ: cứ 1 mol N2 phản ứng với 3 mol H2, sinh ra 2 mol NH3. Vì vậy:
\( - \Delta {C_{{N_2}}} = - \frac{1}{3}\Delta {C_{{H_2}}} = \frac{1}{2}\Delta {C_{N{H_3}}}\)
- Tốc độ trung bình của phản ứng được tính theo biểu thức:
\({v_{tb}} = - \frac{{\Delta {C_{{N_2}}}}}{{\Delta t}} = - \frac{1}{3}.\frac{{\Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{1}{2}.\frac{{\Delta {C_{N{H_3}}}}}{{\Delta t}}\)
- Đối với phản ứng tổng quát: aA + bB → dD + eE
- Gọi \(\Delta {C_A}\), \(\Delta {C_B}\), \(\Delta {C_D}\), \(\Delta {C_E}\) lần lượt là biến thiên lượng chất các chất A, B, D, E trong khoảng thời gian \({\Delta t}\). Tốc độ trung bình của phản ứng được tính theo biểu thức:
\({v_{tb}} = - \frac{1}{a}\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}} = \frac{1}{e}.\frac{{\Delta {C_E}}}{{\Delta t}}\)
|
- Tốc độ phản ứng đặc trưng cho sự nhanh chậm của một phản ứng hoá học. - Tốc độ trung bình của phản ứng được tính bằng sự thay đổi lượng chất trong một đơn vị thời gian. |
|---|
1.2. Các yếu tố ảnh hưởng đến tốc độ phản ứng
a. Ảnh hưởng của nồng độ đến tốc độ phản ứng
- Sự thay đổi nồng độ các chất tham gia sẽ ảnh hưởng đến tốc độ phản ứng, thông thường, khi nồng độ tăng tốc độ phản ứng sẽ tăng. Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia được xác định bằng thực nghiệm
- Ở nhiệt độ không đồi, tốc độ phản ứng tỉ lệ thuận với tích Số nồng độ các chất phản ứng với số mũ thích hợp. Đối với phản ứng đơn giản (phản ứng chỉ xảy ra qua một giai đoạn), số mũ là hệ số của chất tham gia trong phương trình hoá học.
Ví dụ: Xét phản ứng 2NO + O2 → 2NO2 (1)
- Từ thực nghiệm, xác định được mối liên hệ giữa tốc độ phản ứng (1) và nồng độ các chất tham gia phản ứng:
\(v = k.C_{NO}^2.{C_{{O_2}}}\)
- Trong đó: CNO và Co2 là nồng độ mol của NO và O2 tại thời điểm đang xét, k được gọi là hằng số tốc độ phản ứng; v là tốc độ phản ứng tại thời điểm đang xét.
- Xét tại thời điểm CNO = 1 M và Co2 = 1 M, khi đó v = k. Như vậy: hằng số tốc độ k là tốc độ phản ứng khi nồng độ của tất cả các chất đầu đều bằng đơn vị.
- Đại lượng k đặc trưng cho mỗi phản ứng và chỉ phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ chất phản ứng. Giá trị của k được xác định từ thực nghiệm.
- Ảnh hưởng của nồng độ đến tốc độ phản ứng có thể giải thích như sau: trong quá trình phản ứng. các hạt (phân tử, nguyên tử hoặc ion) luôn chuyển động không ngừng và va chạm với nhau. Những va chạm có năng lượng đủ lớn phá vỡ liên kết cũ và hình thành liên kết mới dẫn tới phản ứng hoá học, được gọi là va chạm hiệu quả.
- Khi nồng độ chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả cũng tăng lên và dẫn đến tốc độ phản ứng tăng.
b. Ảnh hưởng của áp suất đến tốc độ phản ứng
- Trong hỗn hợp khí, nồng độ mỗi khi tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khi tăng lên (Hình 19.4). Việc tăng áp suất hỗn hợp khí cũng tương tự như tăng nồng độ, sẽ làm tốc độ phản ứng tăng.
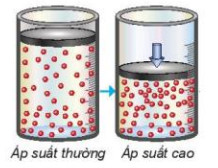
Hình 19.4. Mối liên hệ giữa tăng áp suất và tăng nồng độ
- Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khi tham gia.
c. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
- Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, SỐ va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
- Thực nghiệm cho thấy khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng thường tăng từ 2 đến 4 lần.
- Gọi vt là tốc độ phản ứng tại nhiệt độ T, VT + 10 là tốc độ phản ứng tại nhiệt độ T + 10, khi đó:
\(\frac{{{V_{T + 10}}}}{{{V_T}}} = \gamma \)
- Trong biểu thức trên, \(\gamma \) được gọi là hệ số nhiệt độ Van't Hoff (Van-Hốp). Giá trị \(\gamma \) càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh.
Ví dụ: Xét phản ứng của acetone với iodine.
CH3COCH3 + I2 → CH3COCH2I + HI
- Phản ứng có hệ số nhiệt độ \(\gamma \) trong khoảng từ 30°C đến 50oC là 2,5. Nếu ở 35oC, phản ứng có tốc độ là 0,036 mol/(L.h) thì ở 45oC, phản ứng có tốc độ là 0,036.2,5 = 0,09 mol/(L.h).
d. Ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng
Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
e. Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
- Ảnh hưởng của xúc tác đến tốc độ phản ứng được giải thích dựa vào năng lượng hoạt hoá. Đây là năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hoá học.
- Khi có xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hoá thấp hơn so với phản ứng không xúc tác (Hình 19.5). Do đó số hạt có đủ năng lượng hoạt hoá sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
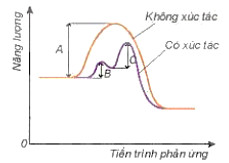
Hình 19.5. Năng lượng hoạt hoá của phản ủng khi không có xúc tác là A và khi có xúc tác với năng lượng hoạt hoả là B, C của các giai đoạn
- Sau phản ứng, khối lượng bản chất hoá học của xúc tác không đồi, tuy nhiên, kích thước, hình dạng hạt, độ xốp,... có thể thay đổi.
|
- Khi nồng độ chất tan trong dung dịch tăng tốc độ phản ứng tăng. - Đối với phản ứng có sự tham gia của chất khí, khi áp suất tăng tốc độ phản ứng tăng. - Khi nhiệt độ phản ứng tăng dẫn đến số va chạm hiệu quả giữa các chất phản ứng tăng, làm tốc độ phản ứng tăng. - Để tăng tốc độ phản ứng ta có thể tăng diện tích bề mặt tiếp xúc của chất phản ứng bằng cách làm giảm kích thước hạt rắn hoặc tạo những hạt xốp. - Chất xúc tác làm tăng tốc độ phản ứng nhưng nó không bị biến đổi về lượng và chất sau phản ứng. |
|---|
1.3. Một số ứng dụng của việc thay đổi tốc độ phản ứng
- Trong đời sống và trong sản xuất, con người áp dụng nhiều biện pháp kĩ thuật để thay đồi tốc độ phản ứng như thay đổi nồng độ, nhiệt độ, dùng chất xúc tác,... Ví dụ: Trong hàn xì, đốt acetylene bằng oxygen nguyên chất cháy nhanh và cho nhiệt độ cao hơn khi đốt bằng oxygen trong không khí.

a) Đèn xì oxygen - acetylene b) Tủ lạnh bảo quản thức ăn c) Bình dưa muối
Hình 19.7. Một số ứng dụng thay đổi tốc độ phản ứng
Bài tập minh họa
Bài 1: Làm thế nào có thể so sánh sự nhanh, chậm của các phản ứng hoá học để thúc đẩy hoặc kìm hãm nó theo mong muốn?
Hướng dẫn giải
Thời gian là đại lượng để xác định sự nhanh, chậm của các phản ứng hóa học.
Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất đầu hoặc sản phẩm trong một đơn vị thời gian: giây(s), phút (min), giờ (h), ngày(d),..
Bài 2: Mối quan hệ giữa tốc độ phản ứng thuận vt và tốc độ phản ứng nghịch vn ở trạng thái cân bằng được biểu diễn như thế nào?
A. vt = 2vn
B. vt = vn
C. vt = 0,5vn
D. vt = vn = 0
Hướng dẫn giải
Đáp án B.
Cân bằng hóa học là khi vt = vn
Bài 3: Cho cân bằng sau trong bình kín. 2NO2 (màu nâu đỏ) ⇌ N2O4 (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có.
A. ΔH < 0, phản ứng toả nhiệt
B. ΔH > 0, phản ứng toả nhiệt
C. ΔH < 0, phản ứng thu nhiệt
D. ΔH > 0, phản ứng thu nhiệt
Hướng dẫn giải
Đáp án A.
Khi hạ nhiệt độ, cân bằng chuyển dịch theo chiều thuận ⇒ phản ứng tỏa nhiệt, ΔH < 0
Bài 4: Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây ?
A. Dạng viên nhỏ.
B. Dạng bột mịn, khuấy đều.
C. Dạng tấm mỏng.
D. Dạng nhôm dây.
Hướng dẫn giải
Đáp án B.
Sử dụng yếu tố diện tích tiếp xúc, dạng bột mịn sẽ cho diện tích tiếp xúc lớn nhất.
Luyện tập Bài 19 Hóa 10 KNTT
Sau bài học này, học sinh có thể:
- Trình bày được khái niệm tốc độ phản ứng hoá học và cách tính tốc độ trung bình của phản ứng.
- Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ (còn gọi là định luật tác dụng khối lượng, chỉ đúng cho phản ứng đơn giản nên không tuỳ ý áp dụng cho mọi phản ứng). Từ đó nêu được ý nghĩa hằng số tốc độ phản ứng.
- Thực hiện được một số thí nghiệm nghiên cứu và giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng (nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác).
- Nêu được ý nghĩa của hệ số nhiệt độ Van't Hoff.
- Vận dụng được kiến thức tốc độ phản ứng hoá học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất.
3.1. Trắc nghiệm Bài 19 Hóa 10 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Kết nối tri thức Bài 19 cực hay có đáp án và lời giải chi tiết.
-
- A. (1) nhanh hơn (2).
- B. (2) nhanh hơn (1).
- C. như nhau.
- D. ban đầu như nhau, sau đó (2) nhanh hơn(1).
-
- A. ΔH < 0, phản ứng toả nhiệt
- B. ΔH > 0, phản ứng toả nhiệt
- C. ΔH < 0, phản ứng thu nhiệt
- D. ΔH > 0, phản ứng thu nhiệt
-
- A. nồng độ, nhiệt độ và chất xúc tác.
- B. nồng độ, áp suất và diện tích bề mặt.
- C. nồng độ, nhiệt độ và áp suất.
- D. áp suất, nhiệt độ và chất xúc tác.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 19 Hóa 10 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Kết nối tri thức Bài 19 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 93 SGK Hóa học 10 Kết nối tri thức - KNTT
Hoạt động trang 93 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 94 SGK Hóa học 10 Kết nối tri thức
Hoạt động trang 95 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 3 trang 96 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 4 trang 97 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 5 trang 97 SGK Hóa học 10 Kết nối tri thức - KNTT
Hoạt động trang 97 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 6 trang 98 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 7 trang 98 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 8 trang 98 SGK Hóa học 10 Kết nối tri thức - KNTT
Hoạt động trang 98 SGK Hóa học 10 Kết nối tri thức - KNTT
Hoạt động trang 99 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 9 trang 99 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 10 trang 100 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 11 trang 100 SGK Hóa học 10 Kết nối tri thức
Giải bài 19.1 trang 53 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.2 trang 53 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.3 trang 53 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.4 trang 54 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.5 trang 54 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.6 trang 54 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.7 trang 54 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.8 trang 54 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.9 trang 54 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.10 trang 55 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.11 trang 55 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.12 trang 55 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.13 trang 55 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.14 trang 55 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.15 trang 55 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.16 trang 56 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.17 trang 56 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.18 trang 56 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.19 trang 56 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.20 trang 56 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.21 trang 56 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.22 trang 57 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.23 trang 57 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.24 trang 57 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.25 trang 57 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.26 trang 58 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.27 trang 58 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.28 trang 59 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.29 trang 59 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.30 trang 59 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.31 trang 60 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.32 trang 60 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.33 trang 60 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.34 trang 61 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 19.35 trang 61 SBT Hóa học 10 Kết nối tri thức - KNTT
Hỏi đáp Bài 19 Hóa học 10 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





