Hoc247.net giới thiệu đến các em tài liệu Bộ 5 đề thi HSG môn Hóa học 11 có đáp án chi tiết năm 2019-2020. Hy vọng qua đề thi này sẽ giúp các em hệ thống lại kiến thức Hóa học, cũng như nắm được cấu trúc của 1 đề thi học sinh giỏi, rèn luyện và nâng cao kỹ năng giải bài tập đa dạng hơn.
BỘ 5 ĐỀ THI HSG MÔN HÓA HỌC 11 CÓ ĐÁP ÁN CHI TIẾT NĂM 2019-2020
ĐỀ SỐ 1:
Câu 1. (4 điểm)
1) Bằng kiến thức về phân bón hoá học, em hãy giải thích câu tục ngữ:
“Lúa chiêm lấp ló đầu bờ
Hễ nghe tiếng sấm phất cờ mà lên”
2) Viết công thức hoặc nêu thành phần chính của lân nung chảy, supephotphat, đạm ure, đạm amoni và giải thích một số kĩ thuật bón phân sau đây:
Lân nung chảy thích hợp với đất chua.
Không nên bón phân supephotphat, phân đạm ure, phân đạm amoni cùng với vôi bột.
3) X và Y là 2 trong số 4 chất sau: NaCl, FeCl2, Fe(NO3)2 và Al(NO3)3. Hòa tan hoàn toàn hỗn hợp hai chất X và Y (có số mol bằng nhau) vào nước thu được dung dịch Z. Chia Z thành 3 phần bằng nhau để tiến hành 3 thí nghiệm:
Thí nghiệm 1: Cho dung dịch NaOH dư vào phần 1, thu được n1 mol kết tủa.
Thí nghiệm 2: Cho dung dịch NH3 dư vào phần 2, thu được n2 mol kết tủa.
Thí nghiệm 3: Cho dung dịch AgNO3 dư vào phần 3, thu được n3 mol kết tủa.
Biết các phản ứng xảy ra hoàn toàn và n1 < n2 < n3.
Hãy chỉ ra cặp chất X, Y phù hợp, viết các phương trình phản ứng xảy ra và giải thích sự lựa chọn đó.
Câu 2. (2 điểm)
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K2O, Ba và BaO (trong đó oxi chiếm 10% về khối lượng) vào nước, thu được 100 ml dung dịch Y và 0,56 lít khí H2 (đktc). Trộn 100 ml dung dịch Y với 400 ml dung dịch gồm HCl 0,4M và HNO3 0,1M, thu được 500 ml dung dịch có pH=1.
1) Viết các phương trình phản ứng hoá học đã xảy ra.
2) Tính giá trị của m.
Câu 3. (2 điểm)
|
Nhỏ từ từ đến dư dung dịch Ba(OH)2 vào dung dịch chứa m gam hỗn hợp Al2(SO4)3, AlCl3 và Al(NO3)3 (trong đó AlCl3 và Al(NO3)3 có số mol bằng nhau). Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol Ba(OH)2 (x mol) được biểu diễn bằng đồ thị (hình bên). |
|
1) Viết các phương trình phản ứng hoá học để giải thích sự biến thiên của đồ thị.
2) Tính giá trị của m.
Câu 4. (2 điểm)
Hoà tan hoàn toàn 7,68 gam Mg vào dung dịch chứa 0,96 mol HNO3, thu được dung dịch X và m gam hỗn hợp khí. Thêm dung dịch chứa 0,8 mol KOH vào X, thu được dung dịch Y, kết tủa và 0,896 lít khí Z (đktc). Lọc bỏ kết tủa, cô cạn Y thu được chất rắn T. Nung T đến khối lượng không đổi, thu được 66,84 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Tính giá trị của m.
Câu 5. (2 điểm)
Nhỏ từ từ 1 lít dung dịch X gồm H2SO4 0,1M và HCl 0,3M vào 1 lít dung dịch Y gồm NaHCO3 0,3M và K2CO3 0,3M, thu được V lít khí CO2 (đktc) và dung dịch Z. Cho dung dịch Ba(OH)2 tới dư vào Z, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn.
1) Viết các phương trình phản ứng hoá học đã xảy ra.
2) Tính các giá trị của V và m.
Câu 6. (4 điểm)
1) Tiến hành thí nghiệm điều chế và thử tính chất của hiđrocacbon X theo sơ đồ và các bước sau đây:
|
|
Bước 1: Mở khoá phễu cho H2O chảy từ từ xuống bình cầu đựng CaC2. Bước 2: Dẫn X vào bình 1 đựng dung dịch Br2. Bước 3: Dẫn X vào bình 2 đựng dung dịch AgNO3 trong NH3. Bước 4: Đốt cháy X. Nêu hiện tượng, viết các phương trình phản ứng hoã học đã xảy ra, gọi tên các phản ứng xảy ra ở bước 2, 3 và 4. |
2) Tiến hành 4 thí nghiệm nghiên cứu tính chất của hiđrocacbon thơm như sau:
Thí nghiệm 1: Cho 0,5 ml brom vào ống nghiệm đựng 5 ml benzen, lắc đều, rồi để ống nghiệm trên giá trong 3 phút, nêu hiện tượng, giải thích. Cho thêm một ít bột sắt vào ống nghiệm, lắc liên tục trong 3 phút, nêu hiện tượng, giải thích.
Thí nghiệm 2: Cho vào cùng một ống nghiệm 3 chất lỏng (2 ml dung dịch HNO3 đặc, 4 ml dung dịch H2SO4 đặc và 2 ml benzen), lắc đều, ngâm trong cốc nước 600C trong 5 phút, rót sản phẩm vào cốc nước lạnh. Nêu hiện tượng và giải thích.
Thí nghiệm 3: Lấy 2 ống nghiệm, cho vào mỗi ống 1 ml dung dịch KMnO4 loãng, sau đó thêm tiếp 1 ml benzen vào ống nghiệm thứ nhất và 1 ml toluen vào ống nghiệm thứ hai, lắc đều, quan sát hiện tượng. Ngâm 2 ống nghiệm vào cùng 1 cốc nước sôi trong 5 phút. Nêu hiện tượng, giải thích.
Thí nghiệm 4: Lấy 1 ống nghiệm hình chữ Y, cho vào nhánh một 1 ml benzen và nghiêng cho benzen dính vào thành ống nghiệm; cho vào nhánh hai một lượng KMnO4 bằng hạt đậu xanh và 1 ml dung dịch HCl đặc, đậy nút và đưa ống nghiệm ra ngoài ánh sáng. Nêu hiện tượng ở nhánh một và giải thích.
Câu 7. (2 điểm)
Đốt cháy 26,7 gam chất hữu cơ X bằng không khí vừa đủ, sản phẩm cháy cho qua bình 1 đựng H2SO4 đặc, dư và bình 2 đựng nước vôi trong dư. Kết quả: khối lượng bình 1 tăng thêm 18,9 gam, bình 2 xuất hiện 90 gam kết tủa; khí thoát ra khỏi bình 2 có thể tích 104,16 lít (đktc). Biết: không khí có 20% thể tích là O2 và 80% thể tích là N2; X có công thức phân tử trùng với công thức đơn giản nhất. Xác định công thức phân tử của X.
Câu 8. (2 điểm)
Một bình kín chứa hỗn hợp khí X gồm propin (0,2 mol), propen (0,3 mol), hiđro (0,5 mol) và một ít bột niken. Nung nóng bình một thời gian, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 14,4. Dẫn khí Y qua bình 1 đựng dung dịch AgNO3 dư trong dung dịch NH3, thu được m gam kết tủa và hỗn hợp khí Z thoát ra. Dẫn khí Z qua bình 2 đựng dung dịch brom dư, thấy có 24 gam brom phản ứng và hỗn hợp khí T thoát ra. Biết các phản ứng hoá học trong bình 1 và bình 2 đã xảy ra hoàn toàn.
1) Viết các phương trình phản ứng hoá học đã xảy ra.
2) Tính giá trị của m.
---(Để xem nội dung đáp án chi tiết đề số 1 vui long xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 2:
Câu 1. (3,0 điểm)
1. Rót nhẹ 1,0 ml benzen vào ống nghiệm chứa sẵn 2,0 ml dung dịch nước brom. Lắc kĩ ống nghiệm, sau đó để yên. Nêu hiện tượng, giải thích.
2. Các hiđrocacbon X, Y, Z, T (thuộc chương trình Hóa học 11, MX < MY < MZ < MT) đều có 7,7 % khối lượng hiđro trong phân tử. Tỷ khối hơi của T so với không khí bé hơn 4,0. Các chất trên thỏa mãn:
- 1 mol chất T tác dụng tối đa 1 mol Br2 trong CCl4.
- Từ chất X, để điều chế chất Y hoặc chất Z chỉ cần một phản ứng.
- Cần 3 phản ứng để điều chế được chất T từ hai chất X và Z.
- Từ mỗi chất X, Y, T chỉ được dùng thêm HCl, H2 và không quá hai phản ứng thu được các polime quan trọng tương ứng dùng trong đời sống là X’, Y’, T’.
a. Xác định công thức cấu tạo, gọi tên các chất X, Y, Z, T, X’, Y’, T’.
b. Viết phương trình các phản ứng xảy ra.
Câu 2. (3,0 điểm)
1. Cân bằng phương trình phản ứng dưới dạng ion thu gọn cho các thí nghiệm sau (mỗi thí nghiệm viết 1 phương trình)
a. Hòa tan FeSx trong dung dịch HNO3 đặc, dư và đun nóng.
b. Cho dung dịch K2S dư vào dung dịch Fe2(SO4)3.
c. Cho dung dịch NH4HSO4 vào dung dịch Ba(HSO3)2.
d. Cho dung dịch Ba(AlO2)2 vào dung dịch Al2(SO4)3.
e. Cho a mol kim loại Ba vào dung dịch chứa a mol NH4HCO3.
2. X là một hợp chất tạo bởi sắt và cacbon có trong một loại hợp kim. Trong X có 93,33% khối lượng của Fe. Hòa tan X trong HNO3 đặc nóng, thu được hỗn hợp khí Y. Cho Y tác dụng với dung dịch NaOH dư, cô cạn dung dịch sau phản ứng, thu được hỗn hợp chất rắn Z. Nung Z đến khối lượng không đổi, thu được hỗn hợp chất rắn T. Hòa tan hỗn hợp T trong dung dịch H2SO4 loãng, đun nóng, thu được hỗn hợp khí Q. Hỗn hợp Q làm nhạt màu dung dịch KMnO4 trong H2SO4 loãng.
a. Xác định công thức phân tử của X và các chất có trong hỗn hợp T.
b. Viết phương trình phản ứng của T với H2SO4, khí Q với dung dịch KMnO4.
Câu 3. (2,0 điểm)
Khi cho hai phân tử isopren đime hóa với nhau, trong đó một phân tử cộng hợp kiểu 1,4 và một phân tử cộng hợp kiểu 3,4 sinh ra phân tử limonen.
1. Hiđro hóa hoàn toàn limonen bởi H2 (Ni, t0) thu được mentan (1-metyl-4-isopropylxiclohexan); còn hiđrat hóa limonen (xúc tác axit) ở nhánh, thu được terpineol. Hiđrat hóa terpineol, thu được terpin (được dùng làm thuốc chữa ho).
Hãy xác định công thức cấu tạo của limonen, mentan, terpineol, terpin.
2. Ozon phân limonen, sau đó xử lý với Zn/CH3COOH thì thu được những sản phẩm hữu cơ nào? Viết công thức cấu tạo của chúng.
Câu 4. (2,0 điểm)
Photpho tồn tại trong tự nhiên ở dạng quặng apatit. Một mẩu quặng apatit gồm canxi photphat, canxi sunfat, canxi cacbonat, canxi florua được xử lí bằng cách cho vào hỗn hợp của axit photphoric và axit sunfuric để tạo thành canxi đihiđrophotphat tan được trong nước dùng làm phân bón.
a. Viết các phương trình hóa học của các phản ứng xảy ra. Giải thích tại sao các phản ứng được thực hiện ở nhiệt độ dưới 600C và trong tủ hốt?
b. Kết quả phân tích thành phần khối lượng một mẫu apatit như sau:
|
Thành phần |
CaO |
P2O5 |
SiO2 |
F |
SO3 |
CO2 |
|
% khối lượng |
52,69% |
39,13% |
2,74% |
1,79% |
3,23% |
1,18% |
Hòa tan m gam mẫu apatit vào lượng vừa đủ 25,0 ml dung dịch H3PO4 1,0M và H2SO4 0,2M. Cô cạn dung dịch sau phản ứng (ở nhiệt độ dưới 600C), thu được m1 gam chất rắn gồm CaSO4.2H2O, Ca(H2PO4)2, SiO2. Tính m và m1.
Câu 5. (2,0 điểm)
Hỗn hợp khí X gồm một ankan, một anken và hiđro. Cho 7,84 lít X đi qua chất xúc tác Ni, nung nóng, thu được 6,72 lít hỗn hợp khí Y. Dẫn Y đi qua dung dịch KMnO4 thì màu của dung dịch bị nhạt và thấy khối lượng bình tăng thêm 2,80 gam. Sau phản ứng, còn lại 4,48 lít hỗn hợp khí Z có tỷ khối so với hiđro là 20,25. Các khí cùng đo ở đktc, các phản ứng xảy ra hoàn toàn.
Hãy xác định công thức phân tử và phần trăm thể tích của các khí có trong hỗn hợp Y.
Câu 6. (2,0 điểm)
Thực hiện hai thí nghiệm sau:
Thí nghiệm 1: Sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp chứa x mol NaOH, y mol KOH và z mol Ba(OH)2.
Thí nghiệm 2: Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch hỗn hợp chứa a mol Al2(SO4)3 và b mol NaHSO4 (a > b).
a. Ở mỗi thí nghiệm, thứ tự các phản ứng xảy ra như thế nào? Viết phương trình các phản ứng đó.
b. Vẽ đồ thị biểu diễn giá trị khối lượng kết tủa theo số mol CO2 (ở thí nghiệm 1) và theo số mol Ba(OH)2 (ở thí nghiệm 2).
Câu 7. (2,0 điểm)
Hòa tan hết 8,96 gam hỗn hợp X gồm Mg, MgCO3, Zn, ZnCO3 trong dung dịch chứa 0,43 mol KHSO4 và 0,05 mol HNO3. Sau khi kết thúc phản ứng, thu được 3,36 lít (đktc) hỗn hợp khí Z gồm CO2, NO, H2 (trong đó H2 chiếm 1/3 thể tích Z) và dung dịch Y chỉ chứa m gam muối trung hòa. Tính m.
Câu 8. (2,0 điểm)
Hòa tan 1,0 gam NH4Cl và 1,0 gam Ba(OH)2.8H2O vào một lượng nước vừa đủ thì thu được 100 ml dung dịch X (ở 250C).
a. Tính pH của dung dịch X, biết pKa (NH4+) = 9,24
b. Tính nồng độ mol/lít của tất cả các ion trong dung dịch X.
c. Tính pH của dung dịch thu được sau khi thêm 10 ml dung dịch HCl 1,0M vào dung dịch X.
Câu 9. (2,0 điểm)
Đốt cháy hết m gam một hiđrocacbon X cần vừa đủ 2,688 lít O2 (đktc). Để phản ứng hết với lượng CO2 sinh ra cần ít nhất 100 ml dung dịch NaOH 0,75M.
Cho X tác dụng với Cl2 (ánh sáng, tỷ lệ mol 1:1) thu được 4 sản phẩm monoclo và phần trăm khối lượng tương ứng là: A (30%), B (15%), C (33%), D (22%).
a. Viết công thức cấu tạo và gọi tên thay thế A, B, C, D.
b. Sản phẩm nào dễ hình thành nhất. Vì sao? Viết cơ chế phản ứng tạo sản phẩm đó.
c. So sánh khả năng thế tương đối của nguyên tử hiđro ở cacbon bậc 1, 2, 3 bởi clo của X.
---(Để xem nội dung đáp án chi tiết đề số 2 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 3:
Câu 1:(2,0 điểm)
1.Hai nguyên tố X, Y đều thuộc nhóm A trong bảng tuần hoàn. Nguyên tử X có tổng số electron ở các phân lớp p là 11, nguyên tử Y có 4 lớp electron và có 2 electron ở lớp ngoài cùng.
a.Viết cấu hình electron nguyên tử và xác định các nguyên tố X, Y.
b.Hoàn thành dãy chuyển hóa (X, Y là các nguyên tố tìm được ở trên)
X2 → HX → YX2 → X2 → YOX2
2.X, Y là 2 nguyên tố thuộc cùng một nhóm A ở 2 chu kì liên tiếp trong bảng tuần hoàn. Nguyên tửX có 6e lớp ngoài cùng. Hợp chất của X với hiđro có %mH = 11,1%. Xác định 2 nguyên tốX, Y.
Câu 2: (2,0 điểm)
1.Lập phương trình hóa học của phản ứng oxi hóa – khử sau:
a.H2S + Cl2 + H2O → H2SO4 + HCl
b.ZnS + HNO3 → Zn(NO3)2 + H2SO4 + NxOy + H2O
2.Có hai dung dịch: Dung dịch A và dung dịch B, mỗi dung dịch chỉ chứa 2 loại cation và 2 loại anion khác nhau trong số các ion sau: NH4+ (0,15 mol); H+ (0,25 mol); Na+ (0,25 mol); CO32- (0,1 mol), NO3- (0,1 mol); Al3+ ( 0,05 mol) ; Br- (0,2 mol) ; SO42- (0,15 mol).
Xác định dung dịch A và dung dịch B. Biết rằng khi cho dung dịch NaOH vào dung dịch A và đun nóng nhẹ thì có khí thoát ra làm xanh giấy quỳ tím ẩm.
Câu 3: (2,0 điểm)
1.X, Y là các hợp chất của photpho. Xác định X, Y và viết các phương trình hóa học theo dãychuyển hóa sau:
P → P2O3 → H3PO3 → X+ dd Ba(OH) dư → Y
2. Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các trường hợp sau:
a. Sục khí H2S vào nước brom, sau đó cho thêm dung dịch BaCl2 vào dung dịch sau phản ứng.
b. Dẫn khí CO2 đến dư vào dung dịch K2SiO3.
c. Nhỏ vài giọt dung dịch phenolphtalein vào dung dịch NH3 loãng, sau đó thêm dung dịch AlCl3 đến dư vào dung dịch sau phản ứng.
d. Sục khí elilen đến dư vào dung dịch KMnO4.
Câu 4: (2,0 điểm)
1.Có 5 dung dịch và chất lỏng mất nhãn, riêng biệt gồm: KHCO3, Ba(HCO3)2, C6H6(benzen), C2H5OH và KAlO2. Chỉ dùng thêm một dung dịch chứa 1 chất tan. Hãy trình bày cách nhận biết các dung dịch và chất lỏng ở trên.
2.Nhỏ từ từ V lít dung dịch chứa Ba(OH)2 0,5M vào dung dịch chứa x mol NaHCO3 và y mol BaCl2. Đồ thị sau biểu diễn sự phụ thuộc giữa số mol kết tủa và thể tích dung dịch Ba(OH)2.
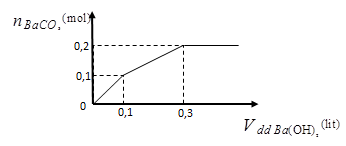
Tính giá trị của x và y.
Câu 5: (2,0 điểm)
1. Hai hiđrocacbon A, B đều có công thức phân tử C9H12. A là sản phẩm chính của phản ứng giữa benzen với propilen (xt H2SO4). Khi đun nóng B với brom có mặt bột sắt hoặc cho B tác dụng với brom (askt) thì mỗi trường hợp đều chỉ thu được một sản phẩm monobrom.
Xác định công thức cấu tạo, gọi tên A, B và viết phương trình hóa học (dạng công thức cấu tạo).
2. Cho 2 ống nghiệm, mỗi ống đựng 2ml nước brom (màu vàng nhạt). Thêm vào ống thứ nhất 0,5ml hexan và vào ống thứ hai 0,5 ml hex-2-en, sau đó lắc nhẹ cả hai ống nghiệm, rồi để yên.
Hãy mô tả hiện tượng ở 2 ống nghiệm và giải thích?
Câu 6: (2,0 điểm)
Cho hỗn hợp khí X gồm 3 hiđrocacbon A, B, C (với B, C là 2 chất kế tiếp nhau trong cùng một dãy đồng đẳng). Đốt cháy hoàn toàn 672 ml hỗn hợp X rồi cho toàn bộ sản phẩm cháy vào bình chứa 437,5 ml dung dịch Ba(OH)2 0,08M, phản ứng xong thu được 4,925 gam kết tủa. Mặt khác, dẫn 1209,6 ml hỗn hợp X qua bình chứa nước brom dư. Sau phản ứng thấy khối lượng bình brom tăng 0,468 gam và có 806,4 ml hỗn hợp khí thoát ra. Biết các thể tích khí đo ở đktc, các phản ứng xảy ra hoàn toàn.
a. Tìm công thức phân tử của A, B, C. Biết A, B, C thuộc trong các dãy ankan, anken, ankin.
b. Tính phần trăm thể tích các chất trong hỗn hợp X.
Câu 7: (2,0 điểm)
1. Có 3 nguyên tố A, B, C. Đơn chất A tác dụng với đơn chất B ở nhiệt độ cao thu được hợp chất X. Chất X bị thủy phân mạnh trong nước tạo ra khí cháy được có mùi trứng thối. Đơn chất B tác dụng với đơn chất C tạo ra khí E. Khí E tan được trong nước tạo dung dịch làm qùy tím hóa đỏ. Hợp chất Y của A với C có trong tự nhiên và thuộc loại hợp chất rất cứng. Hợp chất Z của 3 nguyên tố A, B, C là một muối không màu, tan trong nước và bị thủy phân.
Xác định các nguyên tố A, B, C và các chất X, E, Y, Z và viết phương trình hóa học.
2. Hòa tan hết 12,8 gam hỗn hợp X gồm (Na, Na2O, K, K2O, Ba và BaO), (trong đó oxi chiếm 8,75% về khối lượng) vào nước thu được 600 ml dung dịch Y và 1,568 lít khí H2 (đktc). Trộn 300 ml dung dịch Y với 100 ml dung dịch hỗn hợp gồm HCl 0,4M và H2SO4 0,3M thu được 400 ml dung dịch Z.
Tính pH của dung dịch Z. Biết các phản ứng xảy ra hoàn toàn.
Câu 8: (2,0 điểm)
1. Cho dung dịch chứa 38,85 gammộtmuối vô cơ của axit cacbonic tác dụng vừa đủ với dung dịch chứa 18 gam muối sunfat trung hòa của kim loại hóa trị II, sau phản ứng hoàn toàn thu được 34,95 gam kết tủa.
Xác định công thức 2 muối ban đầu.
2. Cho 16,6 gam hỗn hợp A gồm 2 ancol là đồng đẳng liên tiếp vào bình đựng H2SO4 đặc, ở nhiệt độ thích hợp thu được 13 gam hỗn hợp chất hữu cơ B gồm (2 anken, 3 ete và 2 ancol dư). Đốt cháy hoàn toàn B thu được 17,92 lít CO2 (đktc) và 16,2 gam H2O.
Xác định công thức cấu tạo và tính % số mol mỗi ancol.
Câu 9: (2,0 điểm)
Hòa tan hoàn toàn 6,84 gam hỗn hợp E gồm Mg và kim loại M có hóa trị không đổi cần một lượng dung dịch HNO3 loãng, vừa đủ thu được 0,896 lít (đktc) hỗn hợp khí X gồm N2 và N2O có tỉ khối so với H2 là 16 và dung dịch F. Chia F thành 2 phần bằng nhau. Đem cô cạn phần 1 thu được 25,28 gam muối khan. Phần 2 cho tác dụng với dung dịch NaOH dư thu được 4,35 gam kết tủa.
Xác định kim loại M.
Câu 10: (2,0 điểm)
1.Trong phòng thí nghiệm thường điều chế CO2 từ CaCO3 và dung dịch HCl như hình vẽ sau:
.png)
Để thu được CO2 tinh khiết có 2 học sinh (HS) cho sản phẩm khí qua 2 bình như sau:
HS1: Bình (X) đựng dung dịch NaHCO3 và bình (Y) đựng H2SO4 đặc.
HS2: Bình (X) đựng H2SO4 đặc và bình (Y) đựng dung dịch NaHCO3.
Cho biết học sinh nào làm đúng?
Viết phương trình hóa học giải thích cách làm.
2. Em hãy giải thích:
a. Tại sao không nên bón các loại phân đạm amoni, ure và phân lân cùng với vôi bột?
b. Tại sao không dùng khí CO2 để dập tắt đám cháy của một số kim loại (Mg, Al, …)?
---(Để xem nội dung đáp án chi tiết đề số 3 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 4:
Câu I. (2,0 điểm)
1. Hoàn thành phương trình hóa học của các phản ứng sau:
a. NO2 + NaOH →
b. SO2 + KMnO4 + H2O →
c. S + Na2SO3 →
d. NaNO2 + NH4Cl →
e. Cl2 + KOH →
f. H3PO3 + NaOH (dư) →
g. NaN3 + I2 + H2SO4 (loãng) →
h. NO + Na2S2O4 + NaOH (loãng) →
2. Cho propylbenzen tác dụng với clo chiếu sáng người ta thu được hỗn hợp ba dẫn xuất monoclo A1, A2, A3 với tỉ lệ % lần lượt là 68%, 22%, 10%.
a. Hãy viết cơ chế phản ứng theo hướng tạo thành sản phẩm A1.
b. Hãy tính khả năng phản ứng tương đối của các nguyên tử H ở gốc propyl trong propylbenzen.
Câu II. (2,5 điểm)
1. Hãy gọi tên các chất sau theo danh pháp thay thế:
a. CH2=C(CH3)-CH=CH2
b. CH2=CH-CºCH
c. CH3CHClCH=CH-CH3
d. CH3-CHOH-CH=CH-CH3
e. .png)
f. .png)
2. Viết phương trình phản ứng (ghi rõ điều kiện nếu có) thực hiện sơ đồ chuyển hóa sau:
CH3COOH → A → CH4 → B → C → D → Cao su buna
3. Xác định các chất A, B, C, D, E, F, G, H trong dãy chuyển hóa sau:
.png)
Câu III. (1,75 điểm)
1. Hãy cho biết trạng thái lai hoá của nguyên tử trung tâm và dạng hình học của mỗi phân tử và ion sau đây: BeH2, BF3, NF3, SiF62-, NO2+, I3-.
2. Trong thực tế thành phần của quặng cromit có thể biểu diễn qua hàm lượng của các oxit. Một quặng cromit chứa: 45,240% Cr2O3, 15,870% MgO và 7,146% FeO. Nếu viết công thức của quặng dưới dạng xFe(CrO2)2.yMg(CrO2)2.zMgCO3.dCaSiO3 (x, y, z và d là các số nguyên) thì x, y, z và d bằng bao nhiêu?
Câu IV. (1,75 điểm)
1. Cho cân bằng hóa học: N2 (k) + 3H2 (k) ⇔ 2NH3 (k) ; = - 46 kJ.mol-1 .
Nếu xuất phát từ hỗn hợp chứa N2 và H2 theo tỉ lệ số mol đúng bằng hệ số tỉ lượng 1: 3 thì khi đạt tới trạng thái cân bằng (450oC, 300 atm) NH3 chiếm 36% thể tích.
a. Tính hằng số cân bằng KP.
b. Giữ áp suất không đổi (300 atm), cần tiến hành ở nhiệt độ nào để khi đạt tới trạng thái cân bằng NH3 chiếm 50% thể tích? Giả sử DH0 không thay đổi trong khoảng nhiệt độ nghiên cứu.
2. Hợp chất 2,2,4-trimetylpentan (A) được sản xuất với quy mô lớn bằng phương pháp tổng hợp xúc tác từ C4H8 (X) với C4H10 (Y). A cũng có thể được điều chế từ X theo hai bước: thứ nhất, khi có xúc tác axit vô cơ, X tạo thành Z và Q; thứ hai, hiđro hoá Q và Z. Viết các phương trình phản ứng để minh họa và tên các hợp chất X, Y, Z, Q theo danh pháp IUPAC.
Câu V. (2,0 điểm)
1. Dung dịch A chứa Na2X 0,022M.
a. Tính pH của dung dịch A.
b. Tính độ điện li của ion X2- trong dung dịch A khi có mặt NH4HSO4 0,001 M.
Cho: = 2,00; = 9,24; = 5,30; = 12,60.
2. Trộn 20,00 ml dung dịch H3PO4 0,50 M với 37,50 ml dung dịch Na3PO4 0,40 M, rồi pha loãng bằng nước cất thành 100,00 ml dung dịch A.
a. Tính pH của dung dịch A.
b. Cần phải thêm bao nhiêu ml dung dịch HCl 0,050 M vào 20,00 ml dung dịch A để thu được dung dịch có pH = 4,7.
Cho: 2,15; 7,21; 12,32.
---(Để xem nội dung đáp án chi tiết đề số 4 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 5:
Bài 1 (2,5 điểm)
1. Hoàn thành phương trình hóa học của các phản ứng sau (nếu có):
a) NaClO + CO2 + H2O →
b) CuO + NH3 →
c) Ag2O + H2O2 →
d) Zn3P2 + H2O →
e) NH4NO2 →
f) SiO2 + NaOH (loãng) →
g) O3 + KI + H2O →
h) NaNO2 + H2SO4 loãng →
i) H3PO3 + NaOH (dư) →
k) CaOCl2 + H2SO4 loãng →
2. Viết phương trình hóa học của các phản ứng xảy ra trong các trường hợp sau (nếu có):
a) Sục khí NH3 từ từ đến dư vào dung dịch ZnSO4.
b) Sục khí H2S vào dung dịch nước clo.
c) Sục khí Cl2 vào dung dịch NaHCO3.
d) Cho dung dịch FeCl3 vào dung dịch Na2S.
e) Sục khí SO2 vào dung dịch Fe2(SO4)3.
f) Sục khí clo từ từ đến dư vào dung dịch KBr.
g) Cho khí amoniac (dư) tác dụng với CuSO4.5H2O.
h) Trong môi trường bazơ, H2O2 oxi hoá Mn2+ thành MnO2.
Bài 2 (2,0 điểm)
1. So sánh pH của các dung dịch có cùng nồng độ mol/l của NH3, NaOH và Ba(OH)2. Giải thích.
2. Nhiệt phân một lượng CaCO3, sau một thời gian được chất rắn A và khí B. Cho khí B hấp thụ hoàn toàn vào dung dịch KOH, thu được dung dịch D. Dung dịch D tác dụng được với dung dịch BaCl2 và với dung dịch NaOH. Cho chất rắn A tác dụng với dung dịch HCl dư, được khí B và dung dịch E. Cô cạn dung dịch E, được muối khan F. Điện phân muối F nóng chảy, được kim loại M. Viết phương trình hoá học của các phản ứng xảy ra.
3. Phim đen trắng có phủ lớp bạc bromua trên nền xenlulozơ axetat. Khi được chiếu sáng, lớp bạc bromua bị hoá đen. Phần bạc bromua còn lại trên phim được rửa bằng dung dịch natri thiosunfat; sau đó, người ta thu hồi bạc từ dung dịch nước thải bằng cách thêm KCN và kim loại kẽm. Viết phương trình hóa học của các phản ứng xảy ra.
Bài 3 (2,25 điểm)
1. Cho NO2 tác dụng với dung dịch KOH dư. Sau đó lấy dung dịch thu được cho tác dụng với hỗn hợp Al và Zn. Viết phương trình hóa học của các phản ứng xảy ra.
2. Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Tính nồng độ phần trăm của MgCl2 trong dung dịch Y.
3. Chất A là hợp chất có thành phần chỉ gồm nitơ và hiđro. Chất A được sử dụng làm nhiên liệu cho tên lửa. Ở cùng điều kiện về nhiệt độ và áp suất, một thể tích hơi của A có khối lượng bằng khối lượng của cùng một thể tích khí oxi.
a) Xác định công thức phân tử, công thức cấu tạo của A và cho biết trạng thái lai hóa của nitơ trong A.
b) Dựa vào đặc điểm cấu tạo, hãy so sánh tính bazơ của A với NH3. Giải thích.
Bài 4 (1,75 điểm)
1. Người ta đun nóng một lượng PCl5 trong một bình kín thể tích 12 lít ở 250oC.
PCl5 (k) ⇔ PCl3 (k) + Cl2 (k)
Lúc cân bằng trong bình có 0,21 mol PCl5; 0,32 mol PCl3; 0,32 mol Cl2. Tính hằng số cân bằng KC, KP của phản ứng ở 250oC.
2. Tính độ điện li của ion CO32- trong dung dịch Na2CO3 có pH = 11,6.
Cho: H2CO3 ⇔ HCO3- + H+ ; Ka1 = 10-6,35
HCO3- ⇔ H+ + CO32- ; Ka2 = 10-10,33
3. Tính hằng số cân bằng của phản ứng: Cr2O72- + H2O 2CrO42- + 2H+
Cho: CrO42- + H2O ⇔ HCrO4- + OH- Kb = 10-7,5
Cr2O72- + H2O ⇔ 2HCrO4- K = 10-1,64
Bài 5 (1,5 điểm)
1. Thực nghiệm cho biết đồng tinh thể có khối lượng riêng D = 8,93 g/cm3; bán kính nguyên tử đồng là 1,28.10-8 cm. Đồng kết tinh theo mạng tinh thể lập phương đơn giản hay lập phương tâm diện? Tại sao? (Cho Cu = 63,5)
2. Cho các ion sau đây: He+, Li2+.
a) Hãy tính năng lượng E2 theo đơn vị kJ/mol cho mỗi ion trên.
Cho 1 eV = 1,602.10-19J; NA = 6,022.1023 mol-1.
b) Có thể dùng trị số nào trong các trị số năng lượng tính được ở trên để tính năng lượng ion hóa của hệ tương ứng? Tại sao?
...
Trên đây là một phần trích đoạn nội dung Bộ 5 đề thi HSG môn Hóa học 11 có đáp án chi tiết năm 2019-2020. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào website hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập .
Các em quan tâm có thể tham khảo thêm các tài liệu cùng chuyên mục:
- Đề thi thử HSG môn Hóa học 11 năm 2019-2020 Trường THPT Nguyễn Bỉnh Khiêm
- Đề thi chọn HSG môn Hóa học 11 năm 2019-2020 Tỉnh Quảng Trị
Chúc các em học tập tốt !
Tư liệu nổi bật tuần
- Xem thêm
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)



.png?enablejsapi=1)
.png)