Nội dung bài giảng Phenol tính chất vật lý, ứng dụng của phenol, định nghĩa, ảnh hưởng qua lại giữa các nhóm nguyên tử trong phân tử, tính chất hoá học, điều chế phenol.
Tóm tắt lý thuyết
1.1. Định nghĩa, phân loại
1.1.1. Định nghĩa
- Phenol là những hợp chất hữu cơ trong phân tử có nhóm –OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen.
- Nhóm –OH liên kết trực tiếp vưói nguyên tử cacbon của vòng benzen được gọi là nhóm –OH phenol.
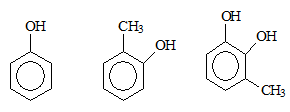
- Ví dụ:
1.1.2. Phân loại (2 loại)
- Phenol đơn chức: phân tử có một nhóm –OH phenol.
- Ví dụ:
- Ví dụ:
-
Phenol đa chức: phân tử có hai hay nhiều nhóm –OH phenol.
-
Ví dụ:
1,2-đihidroxi-3-metylbenzen
-
1.2. Phenol
1.2.1. Cấu tạo
- CTPT: C6H6O
- CTCT:
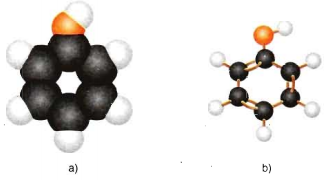
Hình 1: Mô hình phân tử Phenol
a) Dạng đặc b) Dạng rỗng
1.2.2. Tính chất vật lí
- Phenol là chất rắn, không màu, nóng chảy ở 43oC.
- Khi để lâu trong không khí, phenol chuyển thành màu hồng do bị oxi hoá chậm trong không khí.
- Phenol rất độc, gây bỏng da.
- Ít tan trong nước lạnh, tan nhiều trong nước nóng.
1.2.3. Tính chất hóa học
a. Phản ứng thế nguyên tử H của nhóm –OH
- Với kim loại kiềm: C6H5-OH + Na → C6H5-ONa + 1/2H2.
- Với dung dịch bazơ: C6H5-OH + NaOH → C6H5-ONa + H2O.
→ phenol có tính axit yếu.
C6H5ONa + H2O + CO2 → C6H5OH + NaHCO3
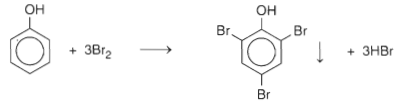
b. Phản ứng thế nguyên tử H của vòng benzen
2,4,6- tribromphenol
Video 1: Phenol làm mất màu dung dịch Brom
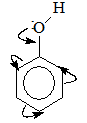
- Nhận xét: Nguyên tử H của vòng benzen trong phân tử phenol dễ bị thay thế hơn nguyên tử H của vòng benzen trong phân tử các hidrocacbon thơm. Đó là do ảnh hưởng của nhóm -OH tới vòng benzen.
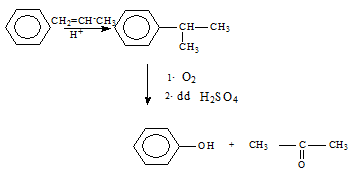
1.2.4. Điều chế
Hoặc: C6H6 → C6H5Br → C6H5ONa → C6H5OH
1.2.5. Ứng dụng
- Dùng để sản xuất nhựa phenolfomanđehit, nhựa urefomanđehit…
- Sản xuất phẩm nhuộm, thuốc nổ, chất diệt cỏ…
Hình 2: Ứng dụng Phenol làm chất dẻo, thuốc nhuộm, thuốc nổ TNT, Thuốc trừ cỏ 2,4-D
Bài tập minh họa
Bài 1:
Cho các phát biểu sau đúng hay sai? Giải thích tại sao?
(1) Phenol tan vô hạn trong nước ở 660C.
(2) Phenol có lực axit mạnh hơn ancol etylic.
(3) Phản ứng thế vào benzen dễ hơn phản ứng thế vào nhân thơm của phenol.
(4) Phenol tan tốt trong etanol.
(5) Phenol làm quí tím hóa đỏ.
(6) Phenol phản ứng được với Brom ở điều kiện thường.
Hướng dẫn:
(1) Phenol tan vô hạn trong nước ở 660C. ⇒ Đúng.
(2) Phenol có lực axit mạnh hơn ancol etylic. ⇒ Đúng.
(3) Phản ứng thế vào benzen dễ hơn phản ứng thế vào nhân thơm của phenol. ⇒ Sai. Phản ứng thế vào benzen khó hơn.
(4) Phenol tan tốt trong etanol. ⇒ Đúng.
(5) Phenol làm quí tím hóa đỏ. ⇒ Sai. Phenol không làm đổi màu quỳ tím.
(6) Phenol phản ứng được với Brom ở điều kiện thường. ⇒ Đúng.
Bài 2:
Cho m gam hỗn hợp A gồm phenol (C6H5OH) và axit axetic tác dụng vừa đủ với p gam dung dịch nước brom C%, sau phản ứng thu được dung dịch B và 33,1 gam kết tủa trắng. Để trung hòa hoàn toàn B cần 144,144 ml dung dịch NaOH 10% (d = 1,11 g/ml). Giá trị của m là?
Hướng dẫn:
C6H5OH + 3Br2 → C6H2OH(Br)3 + 3HBr
⇒ nkết tủa = nphenol = 0,1 mol
\(n_{NaOH }= n_{HBr} + n_{CH_{3}COOH } \Rightarrow n_{CH_{3}COOH } = 0,1 \ mol\)
⇒ m = 15,4g
Bài 3:
Cho m gam hỗn hợp gồm phenol (C6H5OH) và rezoxinol (1,3-đihiđroxibenzen) tác dụng vừa đủ với 400 ml dung dịch brom 1,5M (lượng tối đa) thu được 67,48 gam kết tủa. Giá trị của m là?
Hướng dẫn:
C6H5OH + 3Br2 → HOC6H2Br3 + 3HBr
x → 3x → x
C6H4(OH)2 + 3Br2 → (HO)2C6HBr3 +3HBr
y → 3y y
⇒ \(n_{Br_{2}}\) = 3x + 3y = 0,6 mol
mkết tủa = 331x + 347y = 67,48g
⇒ x = 0,12; y = 0,08 mol
⇒ m = 20,08g
3. Luyện tập Bài 41 Hóa học 11
Sau bài học cần nắm:
- Tính chất vật lý, ứng dụng của phenol.
- Định nghĩa, ảnh hưởng qua lại giữa các nhóm nguyên tử trong phân tử, tính chất hoá học, điều chế phenol.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 41 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. ở điều kiện thường phenol rất ít tan trong H2O
- B. Phenol vừa phản ứng được với dung dịch KOH, vừa phản ứng được với dung dịch Br2
- C. Trong công nghiệp phenol được tạo ra khi oxihóa cumen
- D. phenol phản ứng với CH3COOH tạo ra este
-
- A. 4.
- B. 6.
- C. 5.
- D. 7.
-
- A. 6.
- B. 4.
- C. 5.
- D. 7.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 41.
Bài tập 1 trang 193 SGK Hóa học 11
Bài tập 2 trang 193 SGK Hóa học 11
Bài tập 3 trang 193 SGK Hóa học 11
Bài tập 4 trang 193 SGK Hóa học 11
Bài tập 5 trang 193 SGK Hóa học 11
Bài tập 6 trang 193 SGK Hóa học 11
Bài tập 41.1 trang 65 SBT Hóa học 11
Bài tập 41.2 trang 65 SBT Hóa học 11
Bài tập 41.3 trang 65 SBT Hóa học 11
Bài tập 41.4 trang 65 SBT Hóa học 11
Bài tập 41.5 trang 65 SBT Hóa học 11
Bài tập 41.6 trang 66 SBT Hóa học 11
Bài tập 41.7 trang 66 SBT Hóa học 11
Bài tập 41.8 trang 66 SBT Hóa học 11
Bài tập 41.9 trang 66 SBT Hóa học 11
Bài tập 1 trang 232 SGK Hóa học 11 nâng cao
Bài tập 2 trang 232 SGK Hóa học 11 nâng cao
Bài tập 3 trang 233 SGK Hóa học 11 nâng cao
Bài tập 4 trang 233 SGK Hóa học 11 nâng cao
Bài tập 5 trang 233 SGK Hóa học 11 nâng cao
Bài tập 6 trang 233 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 41 Chương 8 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.