Giải bài OT5.9 trang 61 SBT Hóa học 10 Chân trời sáng tạo
Cho phương trình nhiệt hoá học sau:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) \({\Delta _r}H_{298}^0 = - 57,3{\rm{ }}kJ\)
a) Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
b) Tính lượng nhiệt toả ra khi dùng dung dịch có chứa 8 g NaOH trung hoà với lượng vừa đủ dung dịch HCl.
Hướng dẫn giải chi tiết bài OT5.9
Phương pháp giải:
- Tính số mol Na => Tính \({\Delta _r}H_{298}^0\) theo phản ứng có số mol Na tương ứng
+ Chất tham gia gấp bao nhiêu lần về khối lượng/ số mol => \({\Delta _r}H_{298}^0\) gấp bấy nhiêu lần
+ Khi đảo chiều phản ứng => \({\Delta _r}H_{298}^0\) có giá trị ngược lại
Lời giải chi tiết:
a) Sơ đồ biểu diễn biến thiên enthalpy của phản ứng
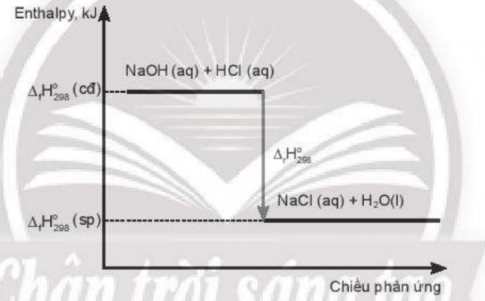
b)
nNaOH = \(\frac{8}{{40}}\) = 0,2 mol
\({\Delta _r}H_{298}^0 = 0,2.( - 57,3) = - 11,46kJ\)
-- Mod Hóa Học 10 HỌC247
Bài tập SGK khác
Giải bài OT5.7 trang 61 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài OT5.8 trang 61 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài OT5.10 trang 61 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài OT5.11 trang 62 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài OT5.12 trang 62 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài OT5.13 trang 62 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài OT5.14 trang 62 SBT Hóa học 10 Chân trời sáng tạo - CTST
Chưa có câu hỏi nào. Em hãy trở thành người đầu tiên đặt câu hỏi.





