Giải bài OT3.8 trang 42 SBT Hóa học 10 Chân trời sáng tạo
Liên kết hydrogen có phải là sự xen phủ giữa các orbital? Giải thích và cho ví dụ minh hoạ.
Hướng dẫn giải chi tiết bài OT3.8
Phương pháp giải:
Dựa vào định nghĩa liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
Lời giải chi tiết:
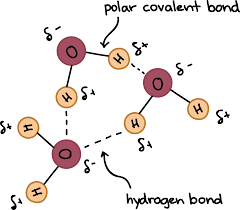
Liên kết hydrogen không phải là sự xen phủ giữa các orbital, mà chỉ là lực hút tĩnh điện giữa nguyên tử hydrogen mang một phần điện tích âm đã liên kết với một nguyên tử có độ âm điện lớn (thường là N, O, F) với một nguyên tử có độ âm điện lớn khác (thường là N, O, F). Ví dụ ta có liên kết hydrogen giữa các phân tử H2O như sau:
-- Mod Hóa Học 10 HỌC247
Bài tập SGK khác
Chưa có câu hỏi nào. Em hãy trở thành người đầu tiên đặt câu hỏi.


