Giải bài 17.21 trang 77 SBT Hóa học 10 Chân trời sáng tạo
Tại sao trong hợp chất của halogen, nguyên tố fluorine chỉ thể hiện số oxi hoá −1, còn các nguyên tố chlorine, bromine, iodine là −1, +1, +3, +5, +7?
Hướng dẫn giải chi tiết bài 17.21
Phương pháp giải:
Dựa vào độ âm điện của fluorine để giải thích
Lời giải chi tiết:
Cấu hình electron lớp ngoài cùng của nguyên tử halogen ns2np5, có 1 electron không ghép đôi; chlorine, bromine, iodine tạo hợp chất có mức oxi hoá –1 khi liên kết với nguyên tử có độ âm điện nhỏ hơn như kim loại, hydrogen,... và tạo mức oxi hoá +1 khi liên kết với nguyên tử có độ âm điện lớn hơn như oxygen, fluorine,...
Ngoài ra, chlorine, bromine, iodine còn các ô lượng tử chưa lấp đầy, có thể xảy ra các quá trình kích thích electron lên phân mức năng lượng cao hơn, tạo ra mức oxi hoá +3, +5, +7.
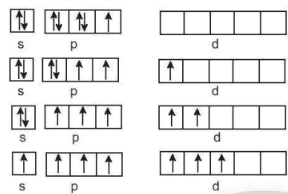
Cấu hình electron của fluorine là 1s22s22p5 ở lớp electron ngoài cùng có 1 electron không ghép đôi, không có ô lượng tử trống, khi hình thành liên kết hoá học, không có nguyên tử nào có độ âm điện lớn hơn fluorine đủ để cung cấp năng lượng cho quá trình kích thích, vì vậy, fluorine chỉ thể hiện mức oxi hoá –1 trong các hợp chất.
-- Mod Hóa Học 10 HỌC247
Bài tập SGK khác
Giải bài 17.19 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 17.20 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 17.22 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 17.23 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 17.24 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 17.25 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 17.26 trang 78 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 17.27 trang 78 SBT Hóa học 10 Chân trời sáng tạo - CTST
Chưa có câu hỏi nào. Em hãy trở thành người đầu tiên đặt câu hỏi.





