Giải bài 11.23 trang 33 SBT Hóa học 10 Cánh Diều
Sử dụng bảng năng lượng của một số liên kết ở điều kiện chuẩn (Phụ lục 2, SGK Hóa học 10, Cánh Diều):
a) Tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ bắt đầu phân hủy thành nguyên tử hai chất trên là 400oC và 1000oC. Theo em, nhiệt độ phân hủy của chất nào cao hơn? Vì sao?
Hướng dẫn giải chi tiết bài 11.23
Phương pháp giải:
Dựa vào bảng số liệu và số liên kết có trong các phân tử
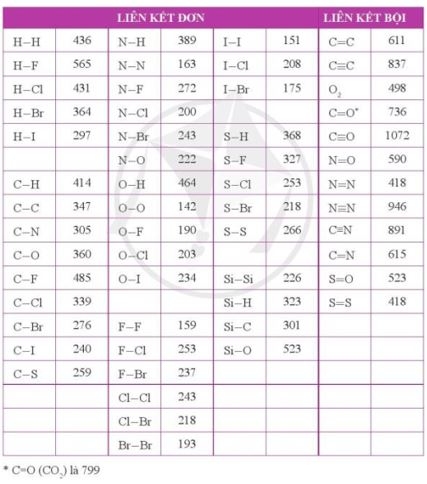
Lời giải chi tiết:
a) Công thức cấu tạo của H2S là H-S-H
→ Năng lượng liên kết trong H2S = 368.2 = 736 (kJ mol-1)
Công thức cấu tạo của H2O là H-O-H
→ Năng lượng liên kết trong H2O = 464.2 = 928 (kJ mol-1)
b) Nhiệt độ phân hủy của H2O cao hơn do liên kết H-O bền hơn liên kết H-S
-- Mod Hóa Học 10 HỌC247
Bài tập SGK khác
Chưa có câu hỏi nào. Em hãy trở thành người đầu tiên đặt câu hỏi.





