HỌC247 xin giới thiệu đến các em Bộ đề thi chọn HSG môn Hóa học 11 năm 2021 có đáp án Trường THPT Nguyễn Thái Bình. Tài liệu được biên soạn nhằm giới thiệu đến các em học sinh các bài tập trắc ngiệm, ôn tập lại kiến thức chương trình môn Hóa học. Hi vọng đây sẽ là 1 tài liệu tham khảo hữu ích trong quá trình học tập của các em.
|
TRƯỜNG THPT NGUYỄN THÁI BÌNH |
ĐỀ THI CHỌN HỌC SINH GIỎI MÔN HÓA HỌC 11 NĂM HỌC 2020-2021 |
ĐỀ SỐ 1
Câu 1 (2,5 điểm)
1. Hoàn thành phương trình hóa học của các phản ứng sau:
a) CaOCl2 + H2O2 →
b) KNO3 (r) + H2SO4 (đặc) →
c) Fe(NO3)2 →
d) PI3 + H2O →
e) KBr (r) + H2SO4 (đặc) →
f) NO2 + H2O →
g) H3PO2 + NaOH (dư) →
h) FeBr2 + KMnO4 + H2SO4 (loãng) →
2. Viết phương trình hóa học của các phản ứng xảy ra trong các thí nghiệm sau (nếu có):
a) Sục khí clo vào dung dịch nước vôi trong.
b) Cho canxi clorua hipoclorit vào dung dịch H2SO4 loãng.
c) Sục khí hiđro sunfua vào dung dịch nước iot.
d) Cho silic vào dung dịch natri hiđroxit.
e) Sục khí clo từ từ đến dư vào dung dịch KI.
f) Sục khí amoniac từ từ đến dư vào dung dịch CuSO4.
g) Cho khí hiđro sunfua lội chậm qua dung dịch A gồm FeCl3, AlCl3, NH4Cl và CuCl2 (nồng độ mỗi chất xấp xỉ 0,1M) cho đến bão hòa.
Câu 2 (1,75 điểm)
1. Người ta có thể điều chế I2 bằng cách oxi hóa I- có trong nước khoáng, nước biển nhờ clo, hoặc natri hipoclorit; natri nitrit; ozon. Viết phương trình ion rút gọn của các phản ứng xảy ra.
2. Cho NO2 tác dụng với dung dịch KOH dư. Sau đó lấy dung dịch thu được cho tác dụng với Zn. Viết phương trình hóa học của các phản ứng xảy ra.
3. Cho X, Y, R, A, B là 5 nguyên tố liên tiếp trong bảng hệ thống tuần hoàn có số đơn vị điện tích hạt nhân tăng dần và tổng số đơn vị điện tích hạt nhân bằng 90.
a) Xác định 5 nguyên tố trên.
b) So sánh bán kính của các ion: X2-, Y-, A+, B2+. Giải thích ngắn gọn.
Câu 3 (1,75 điểm)
1. Cho 29 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 950 ml dung dịch HNO3 1,5M, thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỉ khối của X so với H2 là 16,4. Tính m.
2. Hòa tan hoàn toàn hỗn hợp FeS và FeCO3 bằng dung dịch HNO3 đặc, nóng thu được hỗn hợp khí A gồm 2 khí X, Y. Biết A có tỉ khối so với hiđro bằng 22,909. Tính % khối lượng mỗi muối trong hỗn hợp ban đầu.
Câu 4 (1,75 điểm)
1. Một phản ứng quan trọng tạo nên “mù” gây ô nhiễm môi trường là: O3 (k) + NO (k) →O2 (k) + NO2 (k) Kc = 6.1034
a) Nếu nồng độ ban đầu là: thì phản ứng sẽ diễn ra theo chiều nào?
b) Trong những ngày nóng nực, khi nhiệt độ tăng thì nồng độ các sản phẩm thay đổi như thế nào?
Cho biết:
2. Sắt ở dạng α (Feα) kết tinh trong mạng lập phương tâm khối, cạnh của tế bào sơ đẳng Hãy tính bán kính nguyên tử và khối lượng riêng của sắt.
Câu 5 (2,25 điểm)
1. Trong dung dịch bão hòa của các kết tủa AgBr và AgSCN có các cân bằng sau:
AgBr↓ → Ag+ + Br- T1 = 10-12,3
AgSCN↓ → Ag+ + SCN- T2 = 10-12,0
Hãy tính nồng độ của các ion Ag+, Br-, SCN- trong dung dịch bão hòa của các kết tủa AgBr và AgSCN.
2. a) Tính pH của dung dịch KCN 0,1M. Biết Ka (HCN) = 10-9,35.
b) Tính pH của dung dịch thu được khi trộn 50 ml dung dịch NH3 2.10-4M với 50 ml dung dịch HCl 2.10-4M.
Biết Kb (NH3) = 10-4,76.
---(Nội dung đầy đủ, chi tiết của phần đáp án của đề thi vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 2
Câu 1 (2,5 điểm)
1. Viết công thức các đồng phân ứng với công thức phân tử C4H8.
2. Hoàn thành phương trình hóa học của các phản ứng sau:
a) Stiren + H2 (dư) →
b) p-HOCH2C6H4OH + dung dịch NaOH →
c) But-1-en + HBr (khí) →
d) Etilen glicol →
e) Benzyl bromua + KOH →
f) CH3-CH2-C≡CH + HCl (dư) →
g) 1,4-đibrombutan + Zn →
h) CH3CHO + Cu(OH)2 + NaOH →
i) Stiren + dung dịch KMnO4 →
k) Phenol + HNO3 (loãng) →
l) 3-anlylxiclohexen + K2Cr2O7 + H2SO4 (loãng) →
Câu 2 (1,75 điểm)
1. Gọi tên theo danh pháp IUPAC các chất có công thức sau:
a) (CH3)2CH[CH2]4CH(CH3)CH(CH3)CH2CH3
b) CH3CH2CH(CH3)CH2CHClCH3
c) CH≡C-CH2-CH=CH2
d) CH≡C-CH=CH-CH=CH2
e) (CH3)2CHCH(CH3)OH
f) CH3CH2CH2CH(CHO)CH=CH2
2. Cho clo tác dụng với 2,2,4-trimetylpentan theo tỉ lệ mol 1: 1, thu được các sản phẩm đồng phân có công thức phân tử C8H17Cl.
a) Viết phương trình hoá học của các phản ứng xảy ra (ghi rõ điều kiện phản ứng).
b) Tính tỉ lệ % của mỗi sản phẩm, biết tỉ lệ về khả năng phản ứng của nguyên tử hiđro ở cacbon có bậc khác nhau như sau: CI – H : CII – H : CIII – H = 1 : 3,3 : 4,4.
Câu 3 (2,0 điểm)
1. Hiđrat hóa 5,2 gam axetilen với xúc tác HgSO4 trong môi trường axit, đun nóng. Cho toàn bộ các chất hữu cơ sau phản ứng vào một lượng dư dung dịch AgNO3 trong NH3, thu được 44,16 gam kết tủa. Viết phương trình hóa học của các phản ứng xảy ra và tính hiệu suất của phản ứng hiđrat hóa.
2. Chia hỗn hợp gồm hai ancol đơn chức X và Y (phân tử khối của X nhỏ hơn của Y) là đồng đẳng kế tiếp thành hai phần bằng nhau:
- Đốt cháy hoàn toàn phần 1 thu được 5,6 lít CO2 (đktc) và 6,3 gam H2O.
- Đun nóng phần 2 với H2SO4 đặc ở 140oC tạo thành 1,25 gam hỗn hợp ba ete. Hoá hơi hoàn toàn hỗn hợp ba ete trên, thu được thể tích hơi bằng thể tích của 0,42 gam N2 (trong cùng điều kiện nhiệt độ, áp suất). Tính hiệu suất phản ứng tạo ete của X.
3. Hợp chất hữu cơ A chỉ gồm có C, H, O. Hòa tan 1,03 gam A trong 50 gam benzen rồi xác định nhiệt độ sôi của dung dịch thì thấy ts = 80,3560C, trong khi benzen nguyên chất có ts = 80,10C. Đốt cháy hoàn toàn 21 mg hợp chất A thì thu được 0,0616 gam CO2 và 9,0 mg H2O. Xác định công thức phân tử của A, biết hằng số nghiệm sôi của benzen là 2,61.
Câu 4 (2,0 điểm)
1. Hoàn thành phương trình hóa học của các phản ứng theo sơ đồ sau:

2. Từ các hợp chất hữu cơ có từ 2 nguyên tử cacbon trở xuống, xiclohexan và các chất vô cơ cần thiết hãy viết phương trình hóa học của phản ứng điều chế:
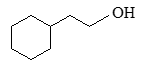
3. Hãy sắp xếp các hợp chất cho dưới đây theo thứ tự tăng dần nhiệt độ sôi. Giải thích.
(CH3)4C (A); CH3[CH2]4CH3 (B); (CH3)2CHCH(CH3)2 (C); CH3[CH2]3CH2OH (D); (CH3)2C(OH)CH2CH3 (E).
Câu 5 (1,75 điểm)
1. p-Ximen (hay 1-metyl-4-isopropylbenzen) có trong tinh dầu bạch đàn, được điều chế từ toluen và propan-1-ol. Viết phương trình hóa học và trình bày cơ chế phản ứng.
Có thể thay propan-1-ol bằng những hóa chất nào? Đối với mỗi hóa chất đó hãy cho biết chất xúc tác cần dùng.
2. Ozon phân một tecpen A (C10H16) thu được B có cấu tạo như sau:
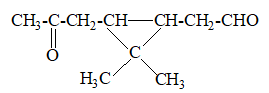
Hiđro hoá A với xúc tác kim loại tạo ra hỗn hợp sản phẩm X gồm các đồng phân có công thức phân tử C10H20.
Xác định công thức cấu tạo của A và các đồng phân trong hỗn hợp X.
3. Cho hợp chất hữu cơ: (CH3)2C=CH–CH2–CH2–CH=C(CH3)2 (A).
Đun nóng (A) với dung dịch axit thu được B (C10H18). Viết công thức cấu tạo của B và trình bày cơ chế của các phản ứng.
---(Nội dung đầy đủ, chi tiết của phần đáp án của đề thi vui lòng xem tại online hoặc đăng nhập để tải về máy)---
...
Trên đây là một phần trích đoạn nội dung Bộ đề thi chọn HSG môn Hóa học 11 năm 2021 có đáp án Trường THPT Nguyễn Thái Bình. Để xem toàn bộ nội dung và đáp án đề thi các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng đề thi này sẽ giúp các em trong học sinh lớp 11 ôn tập tốt và đạt thành tích cao trong kì thi sắp tới.
Ngoài ra các em có thể tham khảo thêm một số tài liệu cùng chuyên mục tại đây:
Tư liệu nổi bật tuần
- Xem thêm
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)


