Hướng dẫn Giải bài tập Hóa học 11 CD Bài 1 Khái niệm về cân bằng hoá học môn Hóa học lớp 11 giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Mở đầu trang 6 SGK Hóa học 11 Cánh diều – CD
Khí NO2 (màu nâu đỏ) liên tục chuyển thành khí N2O4 (không màu) và ngược lại, tại một điều kiện xác định. Cũng tại điều kiện này, bình khí NO2 hay bình khí N2O4 (Hình 1.1), sau những khoảng thời gian xác định đều chuyển thành hỗn hợp khí có thành phần như nhau và không đổi theo thời gian.

Tại thời điểm hỗn hợp khí trong hai bình có thành phần như nhau, có phản ứng diễn ra trong hai bình này không?
-
Giải Câu hỏi 1 trang 7 SGK Hóa học 11 Cánh diều – CD
Hãy nêu một số ví dụ về phản ứng thuận nghịch mà em biết.
-
Luyện tập 1 trang 7 SGK Hóa học 11 Cánh diều – CD
Phản ứng thuận nghịch có xảy ra hoàn toàn được không? Vì sao?
-
Giải Câu hỏi 2 trang 7 SGK Hóa học 11 Cánh diều – CD
Xét ví dụ 2:
a) Giải thích vì sao màu tím của hỗn hợp khí lại nhạt dần so với lúc mới bắt đầu trộn hai khí H2 và I2 với nhau.
b) Sau một khoảng thời gian, màu tím của hỗn hợp không thay đổi, chứng tỏ nồng độ của chất nào không thay đổi?
- VIDEOYOMEDIA
-
Giải Câu hỏi 3 trang 8 SGK Hóa học 11 Cánh diều – CD
Cho hai đồ thị (a) và (b) dưới đây. Mỗi đồ thị biểu diễn sự thay đổi tốc độ của phản ứng thuận và tốc độ của phản ứng nghịch theo thời gian.
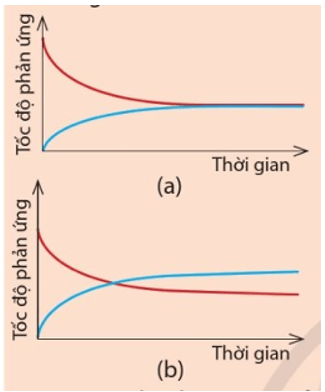
Hãy cho biết đồ thị nào thể hiện đúng Ví dụ 2. Đường màu xanh trong đồ thị đó biểu diễn tốc độ phản ứng thuận hay tốc độ phản ứng nghịch?
-
Giải Câu hỏi 4 trang 8 SGK Hóa học 11 Cánh diều – CD
Vì sao giá trị \(\frac{{{k}_{t}}}{{{k}_{n}}}\) là một hằng số ở nhiệt độ xác định?
-
Giải Câu hỏi 5 trang 9 SGK Hóa học 11 Cánh diều – CD
Viết biểu thức hằng số cân bằng KC cho phản ứng thuận nghịch:
a) N2(g) + 3H2(g) ⇌ 2NH3(g)
b) CaCO3(s) ⇌ CaO(s) + CO2(g)
-
Giải Câu hỏi 6 trang 9 SGK Hóa học 11 Cánh diều – CD
Viết biểu thức hằng số cân bằng KC cho phản ứng (*), (**) dưới đây.
\(\begin{align} & {{H}_{2}}\left( g \right)\text{ }+\text{ }{{I}_{2}}\left( g \right)~\rightleftharpoons ~2HI\left( g \right)\text{ }~~~~~~~~~~~~\text{ }\left( * \right) \\ & \frac{1}{2}{{H}_{2}}\left( g \right)\text{ }\!\!~\!\!\text{ }+\text{ }\!\!~\!\!\text{ }\frac{1}{2}{{I}_{2}}\left( g \right)\rightleftharpoons HI\left( g \right)~~~~~~~~~~~~\left( ** \right) \\ \end{align} \)
Theo em, giá trị hai hằng số cân bằng này có bằng nhau không?
-
Luyện tập 2 trang 9 SGK Hóa học 11 Cánh diều – CD
Trong công nghiệp, halogen được sản xuất từ phản ứng:
CH4(g) + H2O(g) ⇌ 3H2(g) + CO(g)
a) Tính hằng số cân bằng KC của phản ứng trên ở 760 oC.
Biết ở nhiệt độ này, tất cả các chất đều ở thể khí và nồng độ mol của CH4, H2O, H2 và CO ở trạng thái cân bằng lần lượt là 0,126 M; 0,242 M; 1,150 M và 0,126 M.
b*) Ở 760 oC, giả sử ban đầu chỉ có CH4 và H2O có nồng độ bằng nhau và bằng x M. Xác định x, biết nồng độ của H2 ở trạng thái cân bằng là 0,6 M.
-
Vận dụng 1 trang 10 SGK Hóa học 11 Cánh diều – CD
Hãy cho biết trong công nghiệp, để thu được nhiều NH3 hơn thì cần tăng hay giảm nồng độ N2 và H2.
-
Giải Câu hỏi 7 trang 10 SGK Hóa học 11 Cánh diều – CD
Hai acid HA và HB cùng nồng độ ban đầu là 0,5 M, phân li trong nước theo các cân bằng:
HA ⇌ H+ + A-
HB ⇌ H+ + B-
Với các hằng số cân bằng (hay gọi là hằng số phân li acid) tương ứng là KC(HA) = 0,2 và KC(HB) = 0,1.
Tính nồng độ H+ của mỗi dung dịch acid. Rút ra kết luận về mối liên hệ giữa độ mạnh của acid với độ lớn của hằng số phân li acid. Biết rằng acid càng mạnh khi càng dễ tạo ra H+.
-
Luyện tập 3 trang 11 SGK Hóa học 11 Cánh diều – CD
Methanol (CH3OH) là nguyên liệu quan trọng trong công nghiệp hoá học. Dựa vào hằng số cân bằng của các phản ứng ở 25 oC, hãy lựa chọn phản ứng thích hợp để điều chế CH3OH. Giải thích.
CO(g) + 2H2(g) ⇌ CH3OH(g) KC = 2,26.104 (1)
CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) KC = 8,27.10-1 (2)
-
Thí nghiệm 1 trang 11 SGK Hóa học 11 Cánh diều – CD
Chuẩn bị: Ba ống nghiệm (1), (2), (3) chứa NO2 (có màu giống nhau), một cốc nước nóng (70 – 80 oC) và một cốc nước đá.
Tiến hành: Ống nghiệm thứ nhất (1) được để ở nhiệt độ phòng (khoảng 25 oC). Ống nghiệm thứ hai (2) được nhúng vào cốc nước nóng. Ống nghiệm thứ ba (3) được nhúng vào cốc nước đá.
Yêu cầu: Quan sát hiện tượng và giải thích.
Biết NO2 có thể chuyển hoá thành N2O4 theo phản ứng thuận và ngược lại N2O4 có thể chuyển lại thành NO2 theo phản ứng nghịch. Quá trình này được biểu diễn theo phản ứng thuận nghịch sau:
\(\begin{align} & 2N{{O}_{2}}\left( g \right)~\rightleftharpoons ~{{N}_{2}}{{O}_{4}}\left( g \right)~~\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{{\Delta }_{r}}H_{298}^{o}=-58\,kJ\,\,\,\,\left( 8 \right) \\ & nâu\,đỏ\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,không\,màu \\ \end{align} \)
Chú ý an toàn: Khí NO2 độc nên tránh hít phải khí NO2. Nên làm thí nghiệm này trong tủ hút.
-
Giải Câu hỏi 8 trang 11 SGK Hóa học 11 Cánh diều – CD
Từ Thí nghiệm 1, hãy cho biết:
a) Dựa vào dấu hiệu nào để biết trạng thái cân bằng của phản ứng (8) bị chuyển dịch khi thay đổi nhiệt độ.
b*) Khi tăng nhiệt độ hoặc giảm nhiệt độ, cân bằng chuyển dịch theo chiều thu nhiệt hay toả nhiệt?
-
Thí nghiệm 2 trang 12 SGK Hóa học 11 Cánh diều – CD
Chuẩn bị: CH3COONa tinh thể; ống nghiệm, cốc thuỷ tinh.
Tiến hành: Cho một thìa thuỷ tinh tinh thể sodium acetate (CH3COONa) vào ống nghiệm A chứa khoảng 5 mL nước cất, lắc đều cho tan hết, rồi thêm vào ống nghiệm 2 – 3 giọt chất chỉ thị phenolphthalein. Rót khoảng một nửa dung dịch từ ống nghiệm A sang ống nghiệm B, sau đó đặt ống nghiệm B vào một cốc nước nóng (khoảng 70 oC – 80 oC). Sau khoảng 2 phút, quan sát và so sánh màu sắc của dung dịch trong hai ống nghiệm A và B.
Cho biết giữa ion acetate và nước có phản ứng thuận nghịch sau:
CH3COO− + H2O ⇌ CH3COOH + OH− (9)
Yêu cầu: Thảo luận về chiều chuyển dịch cân bằng trên khi nhiệt độ tăng lên.
-
Luyện tập 4 trang 12 SGK Hóa học 11 Cánh diều – CD
Dựa vào thí nghiệm 2, cho biết khi tăng nhiệt độ thì cân bằng (9) chuyển dịch theo chiều thuận hay chiều nghịch?
-
Luyện tập 5 trang 12 SGK Hóa học 11 Cánh diều – CD
Cân bằng sau chuyển dịch theo chiều nào khi tăng nhiệt độ?
2SO2(g) + O2(g) ⇌ 2SO3(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) =−197,8kJ.
-
Giải Câu hỏi 9 trang 12 SGK Hóa học 11 Cánh diều – CD
Cân bằng 2NO2(g) ⇌ N2O4(g) chuyển dịch theo chiều nào khi tăng áp suất của hỗn hợp (bằng cách nén hỗn hợp) ở điều kiện nhiệt độ không đổi. Biết rằng áp suất tỉ lệ với số mol chất khí.
-
Vận dụng 2 trang 13 SGK Hóa học 11 Cánh diều – CD
Quá trình tổng hợp NH3 trong công nghiệp từ N2 và H2 nên thực hiện ở áp suất cao hay áp suất thấp? Giải thích.
Tìm hiểu thông tin, cho biết phản ứng tổng hợp NH3 ở các nhà máy thường được thực hiện ở áp suất nào.
-
Vận dụng 3 trang 13 SGK Hóa học 11 Cánh diều – CD
Thành phần chính của tinh dầu chuối là ester CH3COOCH2CH2CH(CH3)2. Để thu được hỗn hợp chất chứa nhiều ester này thì cần thay đổi nồng độ các chất như thế nào trong cân bằng:
CH3COOH(aq) + ROH(aq) ⇌ CH3CHOOR(aq) + H2O(l)
Với R – là (CH3)2CHCH2CH2 –.
-
Giải Bài 1 trang 14 SGK Hóa học 11 Cánh diều – CD
Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là không đúng?
A. Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
B. Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
C. Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
D. Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
-
Giải Bài 2 trang 14 SGK Hóa học 11 Cánh diều – CD
Cho 0,4 mol SO2 và 0,6 mol O2 vào một bình dung tích 1 lít được giữ ở một nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO3 trong bình là 0,3 mol. Tính hằng số cân bằng KC của phản ứng tổng hợp SO3 ở nhiệt độ trên.
-
Giải Bài 3 trang 14 SGK Hóa học 11 Cánh diều – CD
Nhũ đá được hình thành trong các hang động liên quan đến cân bằng sau đây:
Ca(HCO3)2 (aq) ⇌ CaCO3(s) + CO2(aq) + H2O(l)
Nếu nồng độ CO2 hoà tan trong nước tăng lên thì có thuận lợi cho sự hình thành nhũ đá hay không? Giải thích.


