Phổ khối lượng (Mass spectrometry –MS) thường được sử dụng để xác định nguyên tử khối, phân tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố với độ chính xác cao. Xác định được phân tử khối là một trong những yếu tố quan trọng trong việc lập công thức phân tử hợp chất hữu cơ. Công thức phân tử hợp chất hữu cơ được lập như thế nào từ dữ liệu phân tích nguyên tố và phân tử khối?
Dưới đây là lý thuyết và bài tập minh họa Bài 10. Công thức phân tử hợp chất hữu cơ môn Hóa học lớp 11 Chân Trời Sáng Tạo. Bài giảng đã được HOC247 biên soạn ngắn gọn, đầy đủ, dễ hiểu về công thức phân tử hợp chất hữu cơ, cách lập công thức phân tử của hợp chất hữu cơ và sơ lược về phổ khối lượng MS.
Hi vọng bài giảng dưới đây sẽ giúp các em dễ dàng nắm được nội dung chính của bài.
Tóm tắt lý thuyết
1.1 Xác định phân tử khối của hợp chất hữu cơ
a. Sử dụng kết quả phổ khối lượng để xác định phân tử khối của hợp chất hữu cơ
– Hiện nay, người ta thường sử dụng phổ khối lượng để xác định phân tử khối của hợp chất hữu cơ.
– Trên phổ khối lượng, mỗi tín hiệu (peak) tương ứng với một phân mảnh ion khi các phân tử hợp chất hữu cơ bị ion hoá trong thiết bị phân tích phổ.
– Mỗi peak được xác định bởi giá trị m/z và cường độ tương đối (%).
– Có thể dự đoán phân tử khối của hợp chất hữu cơ đơn giản bằng tín hiệu của mảnh ion phân tử (kí hiệu là [M+]).
– Mảnh ion phân tử này thường ứng với tín hiệu có giá trị m/z lớn nhất.
– Trong thiết bị đo phổ khối lượng, hợp chất hữu cơ thường bị bắn phá bởi các electron có năng lượng cao và bị chuyển thành mảnh ion phân tử.
– Quá trình này được gọi là quá trình ion hoá. Ion phân tử có thể tiếp tục bị phân mảnh để trở thành những phân mảnh ion có khối lượng nhỏ hơn.
– m là khối lượng của ion, z là điện tích của ion. Đa số các ion đều mang điện tích dương +1 nên m/z tương đương với m. Do đó, máy được gọi là máy phân tích khối phố.
%20v%C3%A0%20phenol%20(b.png)
Hình 10.1. Phổ khối lượng của naphtalene (a) và phenol (b)
| Phổ khối lượng có thể cho thông tin về phân tử khối của hợp chất hữu cơ thông qua mảnh ion phân tử thường ứng với tín hiệu có giá trị m/z lớn nhất. |
1.2. Công thức phân tử hợp chất hữu cơ
Lập công thức phân tử hợp chất hữu cơ từ dữ liệu phân tích nguyên tố và phân tử khối
– Công thức phân tử cho biết số nguyên tử của các nguyên tố có trong phân tử.
Ví dụ: Ethylene (C2H4), acetaldehyde (C2H4O), methane (CH4),...
– Để lập công thức phân tử hợp chất hữu cơ, người ta có thể dựa vào dữ liệu phân tích nguyên tố và phân tử khối của hợp chất.
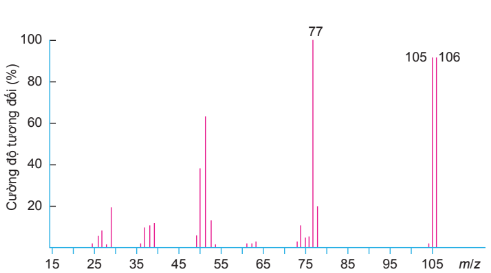
Hình 10.2. Phổ khối lượng của benzaldehyde
– Thiết lập công thức phân tử hợp chất hữu cơ (CxHyOzNt) từ dữ liệu phân tích nguyên tố và phân tử khối (M) được khái quát như sau:
%20.png)
– Với x, y, z, t lần lượt là số nguyên tử C, số nguyên tử H, số nguyên tử O, số nguyên tử N; %mC, %mH, %mO, %mN, lần lượt là % khối lượng của các nguyên tố C, H, O, N trong hợp chất hữu cơ.
Bài tập minh họa
Bài 1. Hợp chất X có công thức đơn giản nhất là CH2O. tỉ khối hơi của X so với hiđro bằng 30. Hãy xác định công thức phân tử của X.
Hướng dẫn giải
CTPT của X là (CHO)n hay CnH2nOn
MX = 30.2 = 60 \(\Rightarrow\) (12 + 2.1 + 16)n = 60 \(\Rightarrow\) n = 2 \(\Rightarrow\) CTPT là C2H4O2
Bài 2. Phân tích chất hữu cơ X chứa C, H, O ta có: mC : mH : mO = 2,24 : 0,357 : 2. Hãy xác định công thức đơn giản nhất của X.
Hướng dẫn giải
Gọi CTPT X là: CxHyOz
\(x:y:z=\frac{{{m}_{C}}}{12}:\frac{{{m}_{H}}}{1}:\frac{{{m}_{O}}}{16}=\text{ }0,187\text{ }:\text{ }0,375\text{ }:\text{ }0,125\text{ }=\text{ }3\text{ }:\text{ }6\text{ }:\text{ }2\)
\(\Rightarrow\) CTĐG: C3H6O2
Luyện tập Bài 10 Hóa 11 Chân Trời Sáng Tạo
Học xong bài học này, em có thể:
– Sử dụng được kết quả phổ khối lượng (MS) để xác định phân tử khối của hợp chất hữu cơ.
– Nêu được khái niệm về công thức phân tử hợp chất hữu cơ.
– Lập được công thức phân tử hợp chất hữu cơ từ dữ liệu phân tích nguyên tố và phân tử khối.
3.1. Trắc nghiệm Bài 10 Hóa 11 Chân Trời Sáng Tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CTST Bài 10 cực hay có đáp án và lời giải chi tiết.
-
- A. Số lượng các nguyên tố trong hợp chất.
- B. Tỉ lệ giữa các nguyên tố trong hợp chất
- C. Cấu trúc phân tử hợp chất hữu cơ.
- D. Tất cả đều sai
-
- A. Số lượng các nguyên tố trong hợp chất.
- B. Tỉ lệ giữa các nguyên tố trong hợp chất
- C. Hàm lượng mỗi nguyên tố trong hợp chất.
- D. Cấu trúc phân tử hợp chất hữu cơ.
-
- A. C2H4O
- B. C2H4O2
- C. C3H6O2
- D. C3H6O
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 10 Hóa 11 Chân Trời Sáng Tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CTST Bài 10 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 57 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 1 trang 57 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 2 trang 58 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 58 SGK Hoá học 11 Chân trời sáng tạo – CTST
Giải Bài 1 trang 59 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 2 trang 60 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 3 trang 60 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hỏi đáp Bài 10 Hóa 11 Chân Trời Sáng Tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





